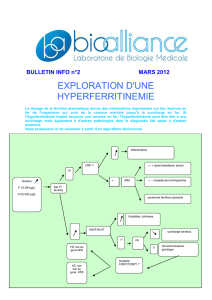
Récepteur soluble de la transferrine: Intérêt chez l`hémodialysé

Récepteur soluble de la transferrine : Intérêt chez l’hémodialysé chronique
1
I
IN
NT
TR
RO
OD
DU
UC
CT
TI
IO
ON
N

Récepteur soluble de la transferrine : Intérêt chez l’hémodialysé chronique
2
Au Maroc, les maladies rénales touchent plus d’un million de personnes. Ils
aboutissent au dialyse chez 4000 malades chaque année, actuellement on compte,
d’après le registre MAGREDIAL près de 9000 patients dialysés, ce chiffre
progresse de 5 à 8% par an. A ce rythme, en 2012, environ 13500 patients auront
besoin de dialyse. Ces statistiques édifiantes tirent la sonnette d’alarme et
doivent inciter les professionnels de la santé à s’engager fortement dans la prise
en charge adéquate de ce type de pathologies, de son retentissement et de ses
complications.
L’anémie est une des complications inéluctables du patient IRC
hémodialysé, cette association anémie-IRC est évoquée pour la première fois en
1836 par BRIGHT qui décrit la pâleur progressive des patients urémiques [1].
La sévérité de cette complication à caractère multifactoriel est grossièrement
proportionnelle à la gravité et au stade de l’insuffisance rénale [2].
La prise en charge de l’anémie des patients IRC hémodialysés a été
révolutionnée par l’introduction de la rHu-EPO dans les années 90. L’apport de
cette molécule a été spectaculaire par l’amélioration des capacités physiques et
intellectuelles des patients, la correction des anomalies cardiaques comme
l’hypertrophie ventriculaire gauche et la quasi-disparition des besoins
transfusionnels. Néanmoins, ce traitement a changé la problématique du statut
martiale et la balance du métabolisme de fer est passée du risque de surcharge en
fer liée à la transfusion itérative au risque de carence martiale par déficit
fonctionnel. Ils ont résulté des situations de résistance à l’rHu-EPO en raison
d’une stimulation importante de l’EPO qui augmente d’autant les besoins en fer.
De plus, la présence fréquente d’un syndrome inflammatoire diminue également
la biodisponibilité de fer par séquestration macrophagique.

Récepteur soluble de la transferrine : Intérêt chez l’hémodialysé chronique
3
Pour corriger l’anémie et ainsi améliorer la qualité de vie des patients, il est
donc nécessaire de porter le diagnostic de cette carence martiale. L’enjeu est
aussi économique, puisqu’il faut éviter que cette carence n’entraîne pas une
surconsommation de la rHu-EPO. L’évaluation du statut martial et notamment le
dépistage du déficit fonctionnel en fer chez l’hémodialysé chronique reste
problématique dans la mesure où les marqueurs classiques du bilan martial sont
souvent pris en défaut pour les raisons déjà évoquées. Les nouvelles
recommandations sur le traitement de l’anémie chez cette catégorie de patients
incluent de nouveaux paramètres (pourcentage de globules rouges hypochromes,
teneur réticulocytaire en hémoglobine) qui ne sont malheureusement pas
disponibles dans tous les laboratoires. Certaines études ont évaluées un nouveau
paramètre de bilan martial, le récepteur soluble de la transferrine. C’est un
paramètre qui a la propriété de refléter non pas les réserves en fer mais la
concentration intracellulaire en fer, notamment des précurseurs érythroblastiques.
Il reflète donc l’apport effectif du fer à la moelle. Il dépend aussi de l’activité
érythropoïétique qui est stimulée par la rHu-EPO.
Nous nous sommes intéressés à ce paramètre chez la population d’IRC
hémodialysé suivis dans le service de néphrologie, dialyse et transplantation
rénale de l’HMIMV et dans un autre centre privé de dialyse. Nous avons étudiés
son rôle comme marqueur du statut martial et de l’érythropoïèse et nous l’avons
comparé aux marqueurs habituels du bilan martial.

Récepteur soluble de la transferrine : Intérêt chez l’hémodialysé chronique
4
P
Pa
ar
rt
ti
ie
e
t
th
hé
éo
or
ri
iq
qu
ue
e
R
Re
ev
vu
ue
e
d
de
e
l
la
a
l
li
it
tt
té
ér
ra
at
tu
ur
re
e

Récepteur soluble de la transferrine : Intérêt chez l’hémodialysé chronique
5
I- METABOLISME DU FER
A- Physiologie
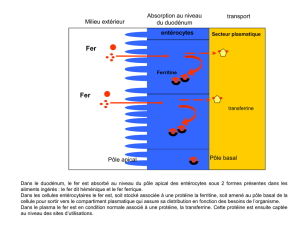
1. Répartition du fer dans l’organisme
Le stock en fer global de l’organisme est d’environ 4 g (l’équivalent du
poids d’un petit clou) chez l’homme adulte normal. Le fer se répartit
quantitativement dans l’organisme entre des sites d’utilisation et des sites de
stockage. Soixante-dix pour cent du fer de l’organisme est utilisé dans la moelle
osseuse, pour être incorporé dans l’hème au cours de la synthèse de
l’hémoglobine. Le muscle est le deuxième site d’utilisation de fer (10-20 % du
fer total), où il est nécessaire à l’activité de certaines protéines (myoglobine en
particulier). Le foie peut capter et stocker des quantités importantes de fer (1g),
notamment lorsque ce dernier est présent en excès dans le plasma [3] (Fig. 1).
Figure 1 : Schéma illustrant la répartition du fer dans l’organisme [4]
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
1
/
124
100%