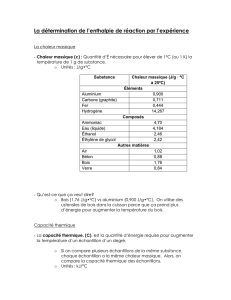
Fiche n° 8 : Thermodynamique - MP*1

MP*1
Fiche n° 8 : Thermodynamique
Capacité thermique à volume constant : en
Capacité thermique molaire à volume constant : en
Capacité thermique massique à volume constant : en
Capacité thermique à pression constante : en
Capacité thermique molaire à pression constante : en
Capacité thermique massique à pression constante : en
Pour un GP :
;
;
Premier principe :
Premier principe simplifiée pour un système sans variation d’énergie
mécanique et n’échangeant que du travail de forces pressantes :
Deuxième principe :
avec si TF irrév
si TF rév
Transformation isochore d’un système fermé :
Transformation isobare d’un système fermé :
fonction enthalpie
Transformation monobare la pression du milieu extérieur est une constante :
Transformation monotherme la température du milieu extérieur est une constante
:

Transformation pour un gaz parfait :
première loi de Joule
deuxième loi de Joule
Transformation isotherme d’un GP :
donc
Cas particulier d’une TF réversible :
ce qui donne :
Transformation adiabatique d’un GP :
Cas particulier d’une TF réversible : loi de Laplace :
Changement de phase du corps pur :
Cas d’un changement de phase réversible :
TF rév, isobare et isotherme : ;
Pour un système diphasé
et
l’enthalpie massique vaut :
l’entropie massique vaut :
Thermodynamique des fluides en écoulement en régime stationnaire :
Débit massique
Premier principe :
1
/
2
100%