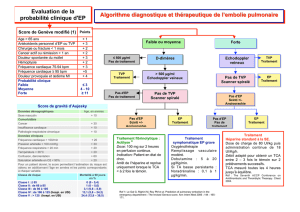
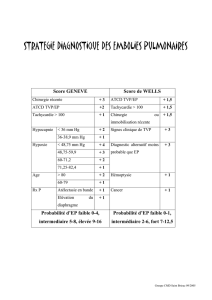
Épidémiologie et facteurs de risque de la maladie thrombo

Mini-revue
Épidémiologie et facteurs de risque
de la maladie thrombo-embolique veineuse du sujet âgé
Claude Jeandel
Centre de prévention et de traitement des maladies du vieillissement, CHU, 34295 Montpellier
<c-jeandel@chu-montpellier.fr>
La maladie thrombo-embolique veineuse (MTEV) représente un pro-
blème de santé publique majeur et sa prévention demeure une préoc-
cupation quotidienne en milieux chirurgical et médical.
Données épidémiologiques
La prévalence moyenne de la MTEV évaluée à partir de séries autopsiques est
de 33 % avec une prévalence de 23 % pour les thromboses veineuses profondes
(TVP) et de 24 % pour les embolies pulmonaires (EP) dont 8 % pour les
embolies mortelles [1].
La prévalence desTVP authentifiées par méthodes isotopiques chez des patients
médicaux ne recevant pas de prophylaxies varie entre 9 et 26 % dans les études
épidémiologiques [2] et dans les groupes contrôles des études cliniques [3]. Elle
est plus élevée chez les patients considérés être à haut risque de maladie
thrombo-embolique veineuse. Elle varie ainsi de 17 à 34 % dans les suites d’un
infarctus du myocarde [4] et de 23 à 75 % après un accident vasculaire cérébral
ischémique [5]. L’étude d’Anderson à Worcester établit à 48/100 000 habitants
l’incidence annuelle des TVP et à 23/100 000 habitants celle de l’embolie
pulmonaire [6].
Le risque thrombo-embolique augmente significativement avec l’âge tant en
milieu chirurgical qu’en milieu médical. La prévalence des TVP en chirurgie
générale s’élève de 19 % avant 60 ans à 36 % après 60 ans et à 65 % après
70 ans. Dans l’étude d’Anderson à Worcester, l’incidence moyenne des TVP
dans les services de court séjour augmente de façon exponentielle avec l’âge [6].
Elle s’élève de 43 à 291/100 000 de la sixième à la neuvième décennie. Après
70 ans, l’incidence de la TVP est 10 fois supérieure à celle des 30-49 ans et est
grevée d’une surmortalité immédiate et tardive (2 à 3 ans après l’événement)
[6]. Dans l’enquête Sirius qui portait sur des patients ambulatoires consultant
leur médecin généraliste pour des manifestations évocatrices de TVP, cette
dernière s’avère significativement plus fréquente après 60 ans [7]. Dans l’étude
de Nylander qui établit l’incidence annuelle de la TVP à près de 1 % dans une
population de 263 144 habitants, sa fréquence est maximale pour les deux sexes
dans la tranche 60-78 ans [8].
Plus fréquente, la maladie thrombo-embolique veineuse est également plus
souvent sous-diagnostiquée ou méconnue chez le sujet âgé. Si les études
Sang Thrombose Vaisseaux 2006 ;
18, n° spécial : 22-6
STV, vol. 18, numéro spécial, mars 2006
22
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

autopsiques montrent la présence d’une embolie pulmo-
naire dans 20 à 30 % des cas après 65 ans, celle-ci est le
plus souvent méconnue.
La maladie thrombo-embolique veineuse est une patholo-
gie fréquente en gériatrie. Son incidence augmente de façon
exponentielle avec l’âge [9, 10], en particulier après 60 ans.
Son incidence annuelle est selon les études comprise entre
3 et 7 ‰ après 75 ans [11]. Les formes pauci ou asympto-
matiques de thrombose veineuse profonde sont plus fré-
quentes chez le sujet âgé. L’étude Tadeus [12] estime la
prévalence deTVP asymptomatiques à l’admission dans un
service de Médecine Interne à 3,3 % entre 55 et 69 ans,
4,1 % entre 70 et 80 ans et 17,8 % après 80 ans. Une étude
récente établit la prévalence de la TVP asymptomatique
dans une unité de soins aigus gériatriques (âge moyen
85 ans) à 12 % [13]. La TVP asymptomatique non traitée,
en particulier dans sa localisation proximale, est de mau-
vais pronostic tout particulièrement chez le sujet âgé.
Les données relatives aux sujets âgés hébergés en institu-
tion sont peu nombreuses et l’incidence de la TVP demeure
encore imprécise dans ces populations. Une étude prospec-
tive a permis d’en établir l’incidence minimale dans une
unité de 120 lits de long séjour à 15 événements pour 100
patients par an [14]. Elle est également plus grave et plus
souvent mortelle, se compliquant d’EP dans 40 % des cas.
W. Coon évalue respectivement à 43 % et à 8,6 % le risque
modéré et élevé de développer une TVP chez des patients
d’âge moyen 85 ans hébergés en long séjour [15].
Pronostic
Le risque d’embolie pulmonaire augmente de manière si-
gnificative avec l’âge [14] et la fréquence des décès par EP
chez les patients âgés hospitalisés est élevée [6]. La TVP
des membres inférieurs et l’embolie pulmonaire sont res-
ponsables en milieu ambulatoire et hospitalier d’un grand
nombre d’erreurs diagnostiques par défaut ou par excès,
rendant compte d’une mortalité élevée. La plupart des
grandes séries autopsiques soulignent le nombre élevé de
décès par embolie pulmonaire (de 13 à 25 %) et leur fré-
quente méconnaissance du vivant du patient [16]. L’EP
massive est responsable de4à8%delamortalité en milieu
hospitalier [17]. La mortalité hospitalière de la maladie
veineuse thrombo-embolique est évaluée à 12 % [18].
L’embolie pulmonaire est incriminée dans les séries autop-
siques hospitalières à l’origine de4à11%desdécès dont
trois-quarts concernent des patients issus de service de
médecine [1]. Dans l’étude de Menin [19], 83 % des 30
patients âgés décédés en moyen séjour présentaient une
embolie pulmonaire authentifiée par angio-pneumographie
post mortem et le diagnostic avait été porté cliniquement
chez seulement 4 des 21 patients. La TVP se complique
d’une embolie pulmonaire documentée chez plus d’un pa-
tient âgé de 80 ans sur deux (52 %) [20]. Volontiers pauci
ou asymptomatique chez le sujet âgé, la TVP se révèle dans
environ un tiers de cas (32 %) par une embolie pulmonaire
[20].
Outre l’embolie pulmonaire et l’hypertension artérielle pul-
monaire pouvant en résulter, la TVP peut se compliquer
d’un syndrome postphlébitique volontiers invalidant.
Vingt-cinq pour cent seulement des décès par embolie
pulmonaire en milieu hospitalier surviennent dans les sui-
tes d’une intervention chirurgicale récente ce qui souligne
l’importance de la prévention de la maladie veineuse
thrombo-embolique chez les patients non chirurgicaux.
Facteurs pathogéniques
Différentes études transversales et longitudinales ont per-
mis d’identifier plusieurs facteurs de risque de la maladie
veineuse thrombo-embolique chez les patients médicaux
[7]. Les premières recensent les facteurs de risque dans des
groupes de patients porteurs d’une TVP documentée. Les
secondes évaluent la fréquence de survenue d’une TVP à
partir des groupes de contrôles des essais cliniques. Si
certains facteurs de risque, tels que l’âge, peuvent être
considérés comme intrinsèques, d’autres résultent des états
pathologiques potentiellement thrombogènes.
Les facteurs de risque intrinsèques au patient
•L’âge représente un des plus importants facteurs de risque
de TVP après la chirurgie. W. Coon dans une étude épidé-
miologique portant sur plus de 4 000 patients a pu établir
que si le risque thrombo-embolique était arbitrairement fixé
à 1 pour un sujet de 35 ans, il s’élevait à 2,2 à 50 ans et
augmentait considérablement au-delà [15].
•L’obésité apparaît au deuxième rang des facteurs de ris-
que après l’âge dans l’étude transversale d’Anderson por-
tant sur un collectif de 1 231 patients porteurs d’une TVP
[21].
•Les antécédents de maladie thrombo-embolique veineuse
(MTEV). Plus d’un quart (26 %) des 1 231 patients de
l’étude d’Anderson présente des antécédents de MTEV.
Dans l’étude cas contrôle Sirius, portant sur des patients
non hospitalisés présentant une TVP, l’existence d’antécé-
dents de MTEV multiplie par 15,6 le risque de TVP [7].
•L’alitement prolongé (supérieur à 5 jours) concerne 12 %
des patients de l’étude d’Anderson et l’immobilisation ré-
cente multiplie par 5,6 le risque de TVP [7]. La fréquence
des thromboses veineuses autopsiques dépasse 50 % après
5 ou 6 jours d’alitement sans traitement antithrombotique
STV, vol. 18, numéro spécial, mars 2006 23
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

quelle que soit la nature chirurgicale ou médicale de la
pathologie à l’origine du décès. À côté de l’immobilisation
totale au lit, où le risque thrombotique est manifeste, la
réduction de l’autonomie d’un patient assurant seulement
ses transferts lit-fauteuil ou confiné au fauteuil roulant
expose également à un risque non négligeable. Le risque de
TVP augmente dans ces conditions si l’on recourt à des
systèmes de contention faisant obstacle au retour veineux.
•L’insuffisance veineuse chronique des membres infé-
rieurs.
•Les états thrombophiliques résultant d’anomalies consti-
tutionnelles ou acquises de la coagulation (déficit en anti-
thrombine III, protéine C, protéine S, résistance à la pro-
téine C activée, déficit en deuxième cofacteur de l’héparine,
anomalies du fibrinogène ou de la fibrinolyse, anticorps
anti-phospholipides).
L’hyperhomocystéinémie résultant d’une carence vitami-
nique (folates, vitamine B6, vitamine B12) apparaît comme
un facteur de risque de MTEV dont le rôle semble augmen-
ter avec l’âge [22].
•Facteurs plus hypothétiques. D’autres facteurs plus hypo-
thétiques pourraient concourir à l’augmentation du risque
de maladie veineuse thrombo-embolique chez le sujet âgé.
Les modifications hémorrhéologiques associées à l’âge et
les modifications de l’équilibre entre les facteurs procoagu-
lants (augmentation du fibrinogène, des facteurs V, VII,
VIII, Xa, de l’activité thrombine, de l’adhésivité plaquet-
taire) et les facteurs anticoagulants (diminution de l’activité
fibrinolytique et de l’antithrombine III) engendreraient un
état naturel d’hypercoagulabilité [23, 24].
Les pathologies à potentiel thrombogène
Si les patients chirurgicaux représentent un groupe relative-
ment homogène vis-à-vis du risque de TVP (la chirurgie du
col fémoral se complique de TVP dans 40 % des cas et
d’embolie pulmonaire dans 5 % des cas) et qu’une attitude
prophylactique relativement bien codifiée peut leur être
appliquée, les patients médicaux apparaissent être un
groupe plus hétérogène à l’égard de ce risque. Des mesures
préventives doivent cependant leur être appliquées car les
trois quarts des patients victimes d’EP sont non-
chirurgicaux. Certaines pathologies cardiologiques ou neu-
rologiques exposent à un risque élevé de MTEV.
•L’infarctus du myocarde récent : la prévalence de la
TVP détectée par le fibrinogène marqué chez les patients
présentant un infarctus du myocarde varie de 17 à 38 %
[20]. Elle est plus élevée quand l’infarctus se complique
d’insuffisance cardiaque (30 à 38 %) [25].
•L’insuffisance cardiaque : la prévalence de la TVP est
de 20 % chez les patients présentant une insuffisance car-
diaque en l’absence d’infarctus du myocarde et d’infection
pulmonaire [2]. Dans l’étude de Cogo et al. portant sur 278
patients hospitalisés pour TVP, le risque de survenue d’une
TVP est multiplié par un facteur proche de 2 s’il existe une
insuffisance cardiaque [26].
•L’accident ischémique cérébral : la prévalence de la
TVP détectée par le fibrinogène marqué varie dans l’acci-
dent ischémique cérébral de 28 à 75 % [5]. Dans 90 % des
cas, la TVP se développe au niveau du membre inférieur
paralysé. Dans 20 à 50 % des cas, elle s’étend en aval de la
région poplitée. Le risque de TVP perdure au-delà de la
phase aiguë de l’accident vasculaire cérébral tant que per-
sistent le déficit moteur et la réduction de l’autonomie.
•Les néoplasies : dans l’étude transversale d’Anderson et
al. portant sur un collectif de 1 231 patients porteurs d’une
TVP, 22,3 % des patients sont porteurs d’une néoplasie et le
cancer se situe au 4
e
rang des facteurs de risque après l’âge,
l’obésité et les antécédents de MTEV [16]. Le risque de
survenue d’une TVP est multiplié par plus de 2 en présence
d’une néoplasie [26]. La fréquence de survenue d’une TVP
en cours d’hospitalisation chez les patients porteurs d’une
néoplasie varie de7à37%[27]. Les cancers exposant au
risque le plus élevé de TVP sont ceux du pancréas, de
l’estomac, de la sphère génito-urinaire, du poumon, du
côlon et du sein.
•Les traumatismes : les traumatismes musculaires récents
multiplient par 7,6 le risque de TVP [7].
•L’insuffisance respiratoire obstructive ou restrictive, la
déshydratation, les troubles du rythme cardiaque.
•Les pathologies à l’origine d’un syndrome inflammatoire
telles que les pathologies infectieuses et systémiques
sévères multiplient par 5,7 le risque de TVP [7]. Kierke-
gaard et al. [2] ont étudié la prévalence de la MTEV chez
des patients admis en court séjour pour pathologie infec-
tieuse. Celle-ci s’établit à 13 % mais la plupart des patients
présentaient une affection cardiaque ou une pneumopathie.
•Les affections favorisant l’hypercoagulabilité et/ou l’hy-
perviscosité (hématocrite > 55 %, plaquettes > 500 000/
mm
3
) telles que les syndromes myéloprolifératifs ou le
syndrome néphrotique peuvent également majorer le risque
de MTEV.
Très peu d’études ont évalué le risque de TVP dans des
groupes médicaux non sélectionnés. La plupart des études
se réfèrent au bras placebo des essais randomisés. Cade et
al. [28] comparent des patients admis en unité de soins
intensifs cardiologiques à un groupe de patients en unité de
soins standard. Un tiers des patients des soins intensifs ont
des antécédents chirurgicaux récents, les autres présentent
une insuffisance respiratoire ou circulatoire. Vingt-neuf
pour cent d’entre eux développent une TVP contre 10 %
dans le groupe hospitalisé en unité de soins standard.
STV, vol. 18, numéro spécial, mars 2006
24
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Indépendamment de l’âge, les antécédents de maladie
thrombo-embolique veineuse, les néoplasies, l’infarctus du
myocarde, l’insuffisance cardiaque et l’accident ischémi-
que cérébral constituent donc les principaux facteurs de
risque de TVP chez le sujet âgé.
Cependant, les malades âgés sont, de plus, volontiers expo-
sés à des pathologies aiguës intercurrentes de nature infec-
tieuse, à des pathologies inflammatoires ou néoplasiques
qui modifient la coagulation, la fibrinolyse, l’activité pla-
quettaire, réduisent l’activité physique et favorisent la dé-
compensation de la fonction ventriculaire gauche.
L’ensemble de ces facteurs intrinsèques et pathologiques
sera fréquemment intriqué pour agir sur une des compo-
santes de la triade de Virchow.
–Les facteurs de stase veineuse : immobilisation ou réduc-
tion de mobilité, surpoids, insuffisance veineuse et vasodi-
latation veineuse postopératoire, insuffisance cardiaque,
sarcopénie (diminution de la masse musculaire des mem-
bres inférieurs) et anomalies de la pompe musculoveineuse.
La pompe musculoveineuse, qui favorise le retour veineux
et s’oppose à la stase en position debout, ne présente pas de
déficit dans sa composante circulatoire chez des sujets âgés
de 80 ans, indemne de pathologie veineuse mais s’avère
déficiente en raison de facteurs locaux extra-vasculaires
(déficit musculaire et de la fonction articulaire), résultant
du vieillissement intrinsèque, de la dénutrition, de l’alite-
ment prolongé et du déconditionnement physique. Son
fonctionnement pourrait donc être amélioré par la correc-
tion de ces facteurs (trophicité musculaire, mobilité articu-
laire) [29].
La fonction veineuse circulatoire est cependant fréquem-
ment altérée chez le sujet âgé par l’effet additif des facteurs
favorisant l’insuffisance veineuse : altération de la pompe
cardiaque, gêne du jeu respiratoire, affaissement de la voûte
plantaire rendant moins efficient l’écrasement de la semelle
veineuse, insuffisance valvulaire consécutive à l’atteinte
pariétale ou séquellaire de thromboses veineuses.
–Les facteurs veineux (anomalies pariétales) : le vieillis-
sement intrinsèque du système nerveux (« phlébosclé-
rose ») se caractérise histologiquement par une fibrose par-
cellaire des trois tuniques de la paroi veineuse respectant les
valvules. Il se manifeste cliniquement par des lacis télan-
giectasiques du tiers inférieur des jambes fréquemment
associés à des signes d’insuffisance veineuse (varices et
dermite ocre). Différentes situations peuvent être à l’ori-
gine des lésions intimales (traumatismes, chirurgie, antécé-
dents de thrombose, brûlures).
–Les modifications hémorrhéologiques et de l’hémostase
induites ou favorisées par l’âge, les néoplasies, la période
postopératoire, l’infarctus du myocarde, la polyglobulie,
l’hémolyse, la déshydratation, et l’inflammation peuvent
conjuguer leurs effets pour créer un état prothromboti-
que : hypercoagulabilié accentuée et entretenue par la stase,
la diminution de la filtrabilité des monocytes, hyperagréga-
bilité plaquettaire, diminution de la fibrinolyse, hyperagré-
gabilité érythrocytaire, augmentation de la viscosité plas-
matique, hyperfibrinogénémie. ■
Références
1. Lindblad B, Sternby NH, Bergvist D. Incidence of venous thromboem-
bolism verified by necropsy over 30 years. BMJ 1991 ; 302 : 709-11.
2. Kierkegaard A, Norgren L, Olson CG, Castenfars J, Persson G,
Persson S. Incidence of deep vein thrombosis in bedridden non surgical
patients. Acta Med Scand 1987 ; 222 : 409-14.
3. Dahan R, Houlbert D, Caullin C, et al. Prevention of deep vein throm-
bosis in elderly medical in-patients by a low molecular weight heparin : a
randomized double-blind trial. Haemostasis 1986 ; 16 : 159-64.
4. Zawilska K. Low dose heparin in the prevention of thrombotic compli-
cation following acute myocardial infarction. Cor Vasa 1989 ; 31 : 179-
85.
5. Turpie AG, Levine MN, Hirsh J, et al. Double-blind randomised trial of
org 10172 low-molecular-weight heparinoid in prevention of deep-vein
thrombosis in thrombotic stroke. Lancet 1987 ; 1 : 523-6.
6. Anderson FA, Wheelher HB, Goldberg RJ, et al. A population based
perspective of the hospital incidence and case fatality rates of deep vein
thrombosis and pulmonary embolism. The Worcester DVT study. Arch
Intern Med 1991 ; 151 : 933-8.
7. Samama MM, Simonneau G, Wainstein JP, De Vathaire F, Huet Y,
Landauer D. SIRIUS study : epidemiology of risk factors of deep vein
thrombosis of the lower limbs in community practive. Thromb Haemostas
1993 ; 69 : 763 ; (ABS 797).
8. Nylander G, Olivecrona H, Hedner U. Earlier and concurrent morbidity
of patients with acute lower leg thrombosis. Actaz Chir Scand 1977;143:
425-9.
9. Stein PD, Hull RD, Kayali F, Ghali WA, Alshab AK, Olson RE. Ve-
nous thromboembolism according to age : the impact of an aging popula-
tion. Arch Intern Med 2004 ; 164 : 2260-5.
10. White RH, Zhou H, Romano PS. Incidence of symptomatic venous
thromboembolism after different elective or urgent surgical procedures.
Thromb Haemost 2003 ; 90 : 446-55.
11. Oger E. Incidence of venous thromboembolism : a community-based
study in Western France. EPI-GETBP Study Group. Groupe d’étude de la
thrombose de bretagne occidentale. Thromb Haemost 2000 ; 83 : 657-60.
12. Oger E, Bressollette L, Nonent M, et al. High prevalence of asympto-
matic deep vein thrombosis on admission in a medical unit among elderly
patients. Thromb Haemost 2002 ; 88 : 592-7.
13. Tiganas D, Durant R, Raschilas F, et al. Intérêt du score de probabilité
clinique dans le diagnostic de thrombose veineuse profonde en gériatrie
La Revue de Médecine Interne. (in press).
14. Manciet G, et al. P. Épidémiologie de la maladie thrombo-embolique
en gériatrie : médecine, réhabilitation, soins prolongés. Rev Gériatr 1993 ;
18 : 119-26.
15. Coon W. Epidemiology of venous thrombo-embolism. Ann Surg
1977 ; 186 : 149-64.
16. Taubman IB, Silverstone PA. Autopsy proven pulmonary embolism
among the institutionalised elderly. J Am Geriatr Soc 1986 ; 34 : 752-6.
STV, vol. 18, numéro spécial, mars 2006 25
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

17. Gross JS, Neufeld RR, Libow LS, Gerber I, Rodstein M. Autopsy
study of the elderly institutionalised patient. Review of 234 autpsies. Arch
Intern Med 1988 ; 148 : 173-6.
18. Thromboembolic Risk Factors Consensus Group. Risk of and prophy-
laxis for venous thromboembolism in hospital patients. BMJ 1992 ; 305 :
567-74.
19. Memin Y, Venet R, Beriot M. Contribution à l’étude de l’embolie
pulmonaire chez le sujet âgé. Med Hyg (Geneve) 1979 ; 37 : 1996-8.
20. Chaix L, Chaix AF, Latour F, et al. La maladie thrombo-embolique
chez la personne âgée de 80 ans et plus. Stratégies diagnostiques et
thérapeutiques. Ann Cardiol Angeiol (Paris) 1994 ; 43 : 437-42.
21. Anderson FA, Wheeler HB. Venous thromboembolism. Risk factors
and prophylaxis. Clin Chest Med 1995 ; 16 : 235-51.
22. Denheijer MD, Koster T, Blom HJ, et al. Hyperhomocysteinemia as a
risk factor for deep-vein thrombosis. N Engl J Med 1996 ; 334 : 759-62.
23. Ciuffetti G, Mercuri M, Rizzo MT, Lennie SE, Lowe GDO. Age and
blood cell rheology. Gerontology 1989 ; 35 : 31-5.
24. Hager K, Setze J, Vogi T, Volt J, Platt D. Blood coagulation factors in
the elderly. Arch Gerontol Geriatr 1989 ; 9 : 277-82.
25. Pitt A, Anderson ST, Habersberger PG, Rosengarten DS. Low-dose
heparin in the prevention of deep-vein thrombosis in patients with acute
myocardial infarction. Am Heart J 1980 ; 99 : 574-8.
26. Cogo A, Bernardi E, Prandoni P, et al. Acquired risk factors for deep-
vein thrombosis in symptomatic outpatients. Arch Intern Med 1994 ; 154 :
164-8.
27. Levine M, Hirsh J, Gent M, et al. Double-blind randomized trial of
very-low-dose warfarin for prevention of thromboembolism in stege IV
breast cancer. Lancet 1994 ; 343 : 886-9.
28. Cade JF. High risk of the critically ill for venous thromboembolism.
Crit Care Med 1982 ; 10 : 448-50.
29. Petermans J, Zicot M. La pompe musculoveineuse de la personne
âgée. J Mal Vasc 1994 ; 19 : 115-8.
STV, vol. 18, numéro spécial, mars 2006
26
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
5
100%