Activité : La cohésion des solides But de l`activité : Comprendre la

Thème : Comprendre
Chap. : Cohésion de la matière
Activité : La cohésion des solides
1ereS
But de l’activité : Comprendre la cohésion des solides.
A. Les solides ioniques
Le chlorure de sodium (ou sel) est un solide ionique communément utilisé. Le chlorure
de césium, lui aussi un solide ionique, est utilisé en médecine nucléaire, dans le
traitement des cancers.
1. De quoi sont composés, en général, les solides ioniques ?
2. Quelle interaction est prédominante dans les solides ioniques ?
3. En faisant le bilan des interactions dans le solide, expliquer la cohésion des solides
ioniques.
B. Les solides moléculaires
Le dichlore Cl2(s), la glace.H2O(s) ou le saccharose C12H22O11(s) sont tous des solides moléculaires.
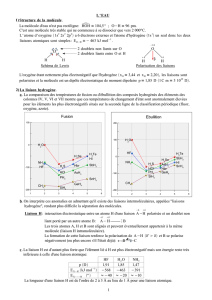
Document 1 : Les interactions de Van des Waals
H2O(s)
Cl2(s)
Les interactions de Van der Waals sont des interactions de nature électrostatique
entre dipôles électriques (permanents ou instantanés).
Molécules polaires
Dans un solide contenant des molécules polaires, les molécules
sont orientées de manière à ce que le barycentre des charges
positives d'une molécule soit toujours voisin du barycentre
des charges négatives d'une autre molécule.
Molécules apolaires
Dans les molécules apolaires, les électrons n'ont pas de position définie et sont en
mouvement permanent autour de deux noyaux. Dans ces
molécules, les électrons du doublet de liaison se situent
statistiquement aussi souvent près d'un noyau que de l'autre :
en moyenne le doublet est donc centré entre les deux atomes
et la molécule est apolaire. Cependant, à un instant donné ces
électrons peuvent être plus proches de l'un des deux noyaux :
il y a alors apparition d'un dipôle électrique instantané.
Les différents dipôles instantanés de la molécule interagissent
de la même façon que des dipôles permanents: ces interactions changent à tout
instant car les dipôles instantanés ne sont pas toujours les mêmes mais les effets
sont permanents.
Document 2 : Les liaisons hydrogène
Une liaison hydrogène est essentiellement de nature électrostatique. C'est une
liaison entre un atome d'hydrogène portant une charge partielle +δ et le doublet
non liant d'un autre atome très électronégatif (O, N, ou F) auquel il n'est pas lié par
une liaison covalente.
On représente cette liaison par des pointillés entre l'atome et le doublet non liant
impliqués.
4. Quelle est la différence entre un solide moléculaire et un solide ionique ?
5. Quelles interactions assurent la cohésion des solides moléculaires ?
6. Expliquer la cohésion du dichlore solide.
7. Expliquer la cohésion de l’eau solide.
NaCl(s)
CsCl(s)

C. Cohésion et changement d’état
8. Expliquer les différentes températures de fusions des solides ci-dessus.
Document 3 : Classement des interactions
Les liaisons de Van der Waals sont plus faibles que les liaisons hydrogènes qui sont elles-mêmes plus faibles que les
liaisons ioniques.
Attention : les liaisons ou interactions entre molécules (intermoléculaires) sont toujours plus faibles que les liaisons covalentes entre atomes à l'intérieur
d'une seule et même molécule mais briser une liaison covalente entraîne une réaction chimique (la molécule change) alors que briser des interactions
ou liaisons intermoléculaires n'entraîne qu'un changement d'état (les molécules restent les mêmes mais sont plus ou moins espacées les unes des
autres).
Document 4 : Propriétés physiques de quelques corps purs
Espèce chimique
eau
dichlore
Chlorure de
césium
Chlorure de
sodium
Formule brute
H2O
Cl2
CsCl
NaCl
Température de fusion
0°C
-101°C
646°C
801°C
1
/
2
100%