Santé Canada approuve la solution pour injection POSANOL

POSANOL® est une marque déposée de MSD International Holdings GmbH, utilisée sous licence.
Communiqué de presse
____________________________________________________________________________________
Personne-ressource pour les médias :
Annick Robinson
438-837-2550
Personne-ressource pour les investisseurs :
Justin Holko
1-908-423-5088
SANTÉ CANADA APPROUVE LA SOLUTION POUR INJECTION
POSANOL® (POSACONAZOLE) : UNE NOUVELLE PRÉSENTATION
INTRAVEINEUSE
Kirkland (Québec), le 13 novembre 2014 – Merck, connue sous le nom de MSD à
l’extérieur du Canada et des États-Unis, a annoncé aujourd’hui l’approbation par
Santé Canada de la solution pour injection POSANOL® (posaconazole) à 300 mg/flacon, une
nouvelle présentation intraveineuse (i.v.). Deux autres présentations de POSANOL pour
administration orale sont également approuvées au Canada : comprimés à libération
retardée POSANOL à 100 mg et suspension orale POSANOL à 40 mg/mL. La solution pour
injection POSANOL devrait être offerte dès la fin du mois de novembre 2014.
Les infections fongiques invasives sont une importante cause de morbidité et de mortalité,
surtout chez les patients gravement immunodéprimés, comme les patients atteints d’une
leucémie myéloïde aiguë (LMA) ou d’un syndrome myélodysplasique (SMD) recevant une
chimiothérapie ou les receveurs d’une greffe de cellules souches hématopoïétiques (GCSH)
subissant un traitement immunosuppresseur à dose élevée en raison d’une réaction du
greffon contre l’hôte (RGCH). Chez les patients neutropéniques et chez les receveurs d’une
GCSH, on rapporte des taux de mortalité attribuable à une aspergillose d’au moins 50 % et
de 86 %, respectivement1.
« Grâce à l’approbation de la solution pour injection du posaconazole, nous disposerons
désormais de trois présentations différentes pour nous aider à répondre aux différents
besoins des patients », explique le Dr Michel Laverdière, spécialiste en maladies
infectieuses à l’Hôpital Maisonneuve-Rosemont. « Cette nouvelle présentation i.v. simplifiera
le traitement des patients incapables de prendre un médicament par voie orale, notamment
en présence de vomissements, d’une mucosite ou d’une diarrhée. »

- 2 -
« L’ajout de cette nouvelle présentation i.v. à la gamme de produits POSANOL offre une option
thérapeutique additionnelle aux patients exigeant un traitement prophylactique contre les
infections à Aspergillus et à Candida ou un traitement contre une aspergillose invasive
réfractaire à l’amphotéricine B ou à l’itraconazole. Cet ajout fait suite à l’approbation récente,
en mai 2014, des comprimés à libération retardée POSANOL, une nouvelle présentation orale
dotée de l’efficacité antifongique de la suspension orale POSANOL et qui offre également un
meilleur profil pharmacocinétique ainsi qu’une administration monoquotidienne après la dose
d’attaque biquotidienne du premier jour », explique le Dr Mauricio Ede, directeur administratif,
Affaires médicales.
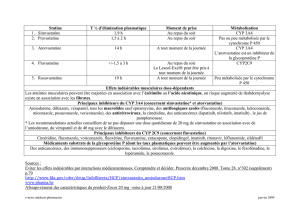
Approbation de la solution pour injection POSANOL (posaconazole) en fonction d’une
étude pharmacocinétique menée auprès de patients
L’approbation de la solution pour injection POSANOL repose sur les résultats d’une étude
multicentrique non comparative visant à évaluer les propriétés pharmacocinétiques ainsi que le
profil d’innocuité et de tolérance de la nouvelle présentation. Cette étude2 a été menée auprès
d’une population de patients semblable à celle qui avait été antérieurement étudiée dans le
programme clinique pivot sur la suspension orale de posaconazole : sujets atteints d’une LMA
ou d’un SMD ayant reçu une chimiothérapie récente et présentant une neutropénie importante
ou chez qui l’on prévoyait une neutropénie importante, ou patients ayant reçu une GCSH et
subissant un traitement immunosuppresseur pour la prévention ou le traitement d’une RGCH.
Dans les études cliniques, les effets indésirables signalés avec la solution pour injection
POSANOL étaient généralement d’un type comparable à celui rapporté dans les études sur la
suspension orale POSANOL. Les effets indésirables le plus souvent rapportés durant la phase
i.v. du traitement avec le posaconazole à 300 mg une fois par jour étaient la diarrhée (32 %),
une hypokaliémie (22 %), la fièvre (21 %) et les nausées (19 %).
Approbation des comprimés à libération retardée POSANOL (posaconazole) en fonction
d’une étude pharmacocinétique menée auprès de patients
L’approbation des comprimés à libération retardée POSANOL repose sur les résultats d’une
étude multicentrique non comparative visant à évaluer les propriétés pharmacocinétiques ainsi
que le profil d’innocuité et de tolérance des comprimés à libération retardée de posaconazole.

- 3 -
Cette étude2 a été menée auprès d’une population de patients semblable à celle qui avait été
antérieurement étudiée dans le programme clinique pivot sur la suspension orale de
posaconazole.
Dans les études cliniques, les effets indésirables le plus souvent rapportés avec les comprimés
à libération retardée POSANOL étaient la diarrhée, la fièvre et les nausées. Les effets
indésirables signalés avec les comprimés à libération retardée POSANOL étaient
généralement d’un type comparable à celui rapporté dans les études sur la suspension orale
POSANOL.
Expérience clinique avec la suspension orale POSANOL (posaconazole)
Deux études cliniques contrôlées et à répartition aléatoire ont été réalisées avec la suspension
orale de posaconazole en tant que traitement prophylactique contre les infections fongiques
invasives chez des patients présentant un risque élevé3-4. Les deux études ont permis de
mettre en évidence un moins grand nombre d’infections perthérapeutiques causées par des
espèces du genre Aspergillus chez les patients recevant un traitement prophylactique avec le
posaconazole, comparativement à ceux recevant le fluconazole ou l’itraconazole. Une
troisième étude a été réalisée avec la suspension orale de posaconazole en tant que
traitement de l’aspergillose invasive chez des patients dont la maladie était réfractaire aux
médicaments classiques, ou chez des patients ne tolérant pas ces médicaments5.
Dans une étude ouverte et à répartition aléatoire visant à comparer la suspension orale de
posaconazole (200 mg trois fois par jour) à une suspension de fluconazole (400 mg une fois
par jour) ou à une solution orale d’itraconazole (200 mg deux fois par jour) en traitement
préventif des infections fongiques invasives chez des patients neutropéniques qui étaient
soumis à une chimiothérapie cytotoxique pour traiter une LMA ou un SMD (n = 602), on a
observé un moins grand nombre d’échecs cliniques pendant le traitement antifongique
prophylactique et sur une période de sept jours suivant la dernière dose du médicament avec
le posaconazole (27 % [82/304]), comparativement au fluconazole ou à l’itraconazole (42 %
[126/298]) (IC à 95 % pour la différence entre le posaconazole et le traitement témoin; -22,9 %
à -7,8 %). Le taux d’échec clinique 100 jours après la répartition aléatoire était de 52 %
(158/304) avec le posaconazole, comparativement à 64 % (191/298) avec le fluconazole ou
l’itraconazole. Le taux de mortalité toutes causes confondues après 100 jours était inférieur

- 4 -
chez les patients recevant le posaconazole (14 % [44/304]), comparativement à ceux traités
avec le fluconazole ou l’itraconazole (21 % [64/298]).
Dans une étude à double insu et à répartition aléatoire visant à comparer la suspension orale
de posaconazole (200 mg trois fois par jour) aux capsules de fluconazole (400 mg une fois par
jour) en traitement préventif des infections fongiques invasives chez les receveurs d’une GCSH
allogénique présentant une RGCH (n = 600), le taux d’échec clinique pendant le traitement et
sur une période de sept jours suivant le traitement était de 17 % (50/301) avec le
posaconazole et de 18 % (55/299) avec le fluconazole. Le taux d’échec clinique jusqu’à la
16e semaine suivant la répartition aléatoire était comparable avec le posaconazole (33 %
[99/301]) et le fluconazole (37 % [110/299]) (IC à 95 % pour la différence entre le
posaconazole et le traitement témoin; -11,5 % à 3,7 %). Le taux de mortalité toutes causes
confondues après 16 semaines était similaire dans les deux groupes de traitement (19 %
[58/301] vs 20 % [59/299], respectivement).
Dans une étude multicentrique ouverte5, on a évalué l’efficacité et l’innocuité de la suspension
orale de posaconazole (800 mg/jour, à raison de doses fractionnées) en monothérapie chez
des patients atteints d’aspergillose invasive qui n’ont pas répondu au traitement antifongique
classique ou qui ne l’ont pas toléré (n = 107). Des données provenant de cas témoins externes
ont été recueillies rétrospectivement pour constituer un groupe de référence aux fins de
comparaison (n = 86). On a observé une réponse globale positive au terme du traitement chez
42 % (45/107) des patients traités avec le posaconazole, comparativement à 26 % (22/86) des
sujets du groupe témoin externe (p = 0,006). Cela dit, comme il ne s’agissait pas d’une étude
prospective contrôlée avec répartition aléatoire, toute comparaison avec le groupe témoin
indépendant doit être perçue avec circonspection.
Les effets indésirables signalés le plus souvent parmi l’ensemble des volontaires en bonne
santé et des patients ont été les nausées et les céphalées.
Le comprimé à libération retardée et la suspension orale POSANOL ne doivent pas être utilisés
de façon interchangeable, la posologie étant différente pour chacun.

- 5 -
À propos de Merck
La société Merck d’aujourd’hui est un chef de file mondial dans le domaine des soins de santé
qui œuvre au bien-être du monde. Merck est connue sous le nom de MSD à l’extérieur du
Canada et des États-Unis. Grâce à nos médicaments d’ordonnance, vaccins, traitements
biologiques, produits de santé grand public et de santé animale, nous collaborons avec nos
clients et œuvrons dans plus de 140 pays à procurer des solutions de santé novatrices. Nous
démontrons également notre détermination à améliorer l’accès aux soins de santé grâce à des
politiques, programmes et partenariats d’envergure. Pour de plus amples renseignements à
propos de nos activités au Canada, visitez le site www.merck.ca.
Déclarations prospectives
Ce communiqué de presse contient des « déclarations prospectives » (forward looking
statements), au sens des dispositions libératoires de la Private Securities Litigation Reform Act
de 1995 des États-Unis. Ces déclarations sont fondées sur les convictions et les prévisions
actuelles de la direction de Merck et sont soumises à de nombreux risques et incertitudes. Rien
ne garantit que les produits au stade expérimental recevront les approbations nécessaires des
organismes de réglementation ou qu’ils auront un succès commercial. Si les hypothèses sous-
jacentes se révèlent inexactes ou si les risques et incertitudes se matérialisent, les résultats
réels pourraient différer substantiellement de ceux annoncés dans les déclarations
prospectives.
Ces risques et incertitudes comprennent, sans s’y limiter, les conditions générales de l’industrie
et la concurrence; les facteurs économiques généraux, incluant les fluctuations des taux
d’intérêt et des taux de change; les effets de la réglementation de l’industrie pharmaceutique
ou des lois concernant les soins de la santé aux États-Unis et dans le monde; les tendances
mondiales à l’égard de la limitation des coûts des soins de santé; les avancées technologiques
et les nouveaux produits et brevets des concurrents; les défis entourant le développement d’un
nouveau produit, incluant l’obtention de l’approbation réglementaire; la capacité de Merck à
prédire précisément les conditions de marché futures; les difficultés ou les retards de
fabrication; l’instabilité financière des économies mondiales et le risque de souveraineté; la
dépendance à l’égard de l’efficacité des brevets de Merck et des autres protections relatives
 6
6
1
/
6
100%