HPV et cancer

Pr Cécile Badoual
Service d’ anatomo-pathologie
Hôpital Européen G Pompidou
Pathologie cervicale et HPV
Prévention, dépistage, diagnostic et suivi

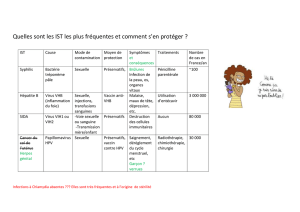
•Le cancer invasif du col est le 2ème cancer féminin à l'échelle
mondiale.
•Human Papillomavirus (HPV)
•Incidence :
–4/100.000 en Finlande à 48/100.000 en Colombie
–en France, 9,5 /100.000, chez les femmes avant 40 ans et
mortalité de 3,5/100 000.
–500 000 nouveaux cas /an : 270 000 décès/an (tiers monde)
•Saignement en dehors des règles, rapports vaginaux, écoulements
vaginaux, douleur tardive
•Dépistage : diminution de mortalité (50%)
•Examen clinique
– examen au spéculum et toucher vaginal (extension vagin, parois
latérales, paramètres) : tumeur évidente
–ou colposcopie pour biopsie
•Radiologie pour apprécier le volume
–Échographie, IRM, Pet scan, scanner
Données épidémiologiques

HPV et clinique
•Un des virus les plus transmis par voie sexuelle à
travers le monde.
•Peut être transmis par simple contact cutané ou
muqueux
• Très forte incidence de l’infection à HPV dans le
monde (660 millions de personnes infectées dans le
monde).
•Impliqué dans la survenue de lésion bénignes
(verrues…) ou de cancers
•Environ 550.000 nx cas / an de cancer HPV
dépendant dans le monde

HPV et cancer
• Prévalence augmentée dans les pays en voie de
développement et à niveau socio-économique bas
• HPV est responsable de 5% des cancers :
cancers du col de l’utérus (++), cancer de la vulve et du
vagin, cancer de l’anus (en augmentation chez les sujets
immunodéprimés)
mais aussi dans d’autres localisations : pénis, ORL,
poumon, vessie…

Structure générale des HPV
• Génome constitué d’une molécule circulaire d’ADN double
brin
•De 7200 à 8000 paires de bases
•Organisation génomique commune:
•Trois cadres de lecture utilisés
•Une dizaine de phases ouvertes de lecture
•Groupées en :
–une région E (early) codant pour des protéines non
structurales
–Une région L (late) codant pour les protéines de
capside
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
1
/
50
100%