Vaccin contre le virus de l`hépatite C : une

Virologie, Vol. 10, n° 2, mars-avril 2006
brèves
149
Vaccin contre le virus de l’hépatite C :
une nouvelle approche utilisant des vecteurs
adénoviraux ?
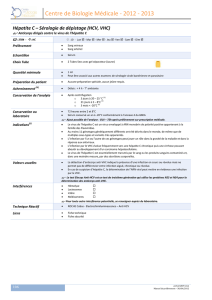
Le virus de l’hépatite C (VHC) infecte environ 200 millions de personnes, soit environ
3 % de la population mondiale. Au moins un tiers des sujets infectés ignorent leur
statut sérologique. En France, 600 000 personnes seraient porteuses du VHC, soit 1 %
de la population, avec 5 000 nouvelles contaminations par an.
Combattre l’hépatite est un défi médical de par les caractéristiques génétiques du VHC
qui lui confèrent une capacité à l’échappement immunitaire et thérapeutique. En effet,
la variabilité génétique du VHC est liée à un taux d’erreurs élevé commises par l’ARN
polymérase au cours de la réplication et à son absence de correction. Les variants ainsi
produits sont continuellement sélectionnés par l’environnement au sein duquel le virus
se réplique. Ces produits sont à l’origine de la distribution en « quasi-espèces » du
VHC, qui circule sous forme d’un mélange complexe.
De par le nombre de personnes touchées, des conséquences cliniques et de ses capa-
cités d’échappement, le VHC est un sérieux problème de santé publique qui impose
une stratégie thérapeutique à la fois curative et préventive adaptée.
Plusieurs idées de vaccins ont fait l’objet de travaux de recherche. La stratégie de
vaccins visant à entraîner une réponse de type humorale seule s’avère controversée
pour éradiquer l’infection par le VHC. En effet, la réponse immunitaire humorale est
beaucoup trop antigène-spécifi que pour un virus avec une telle variabilité génétique.
L’équipe du Pr Nicosia s’est donc tournée vers un modèle de vaccin induisant une
réponse immunitaire de type T cellulaire.
La réponse immunitaire T cellulaire est beaucoup moins stricte qu’une réponse de type
humorale car une certaine variabilité dans la composition de l’épitope est tolérée, ce
qui permet d’obtenir des réactions croisées. C’est sur ce concept que repose le raison-
nement du vaccin de l’équipe italienne [1].
La région retenue pour générer l’immunisation est la région non structurale NS (NS3-
NS5B), qui représente à elle seule les deux tiers du génome du VHC et code cinq
protéines : NS3, NS4A, NS4B, NS5A, NS5B, soit 2 000 acides aminés, ce qui permet
de générer un grand nombre d’épitopes.
Le vaccin est constitué d’un plasmide NSmut codant pour la région NS3-NS5B de la
souche de VHC BK (génotype 1b) et d’un vecteur adénoviral (Ad) humain de première
génération, de deux sérotypes différents (6 et 24), dépourvu de la protéine E1. L’utili-
sation séquentielle de deux vecteurs de sérotypes différents permet d’obtenir un effet
amplifi é de l’immunisation contre le VHC en évitant une réponse immunitaire spéci-
fi que à l’adénovirus.
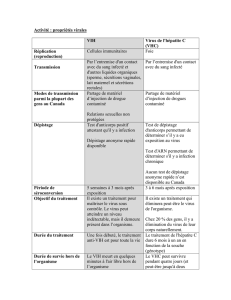
Le schéma de vaccination se décompose en six injections : deux aux semaines 0 et 4
de MRKAd6NSmut, une à la semaine 25 d’Ad24NSmut et trois du plasmide NSmut
seul aux semaines 35, 37 et 39, accompagnées d’un traitement électrique qui permet
une meilleure transduction musculaire du plasmide. Un test d’infection est réalisé à la
semaine 49 avec la souche hétérologue H77 (génotype 1a) du VHC [2].
Au total, 10 chimpanzés ont été suivis : 5 ont reçu le plasmide NSmut et 5 témoins ont
reçu, selon le même schéma, un plasmide témoin codant pour l’antigène gag du VIH1
Mots clés :
vaccine, virus de l’hépatite C,
vecteur adenoviral
jlevir_05-05.indd 149jlevir_05-05.indd 149 5/16/06 3:41:22 AM5/16/06 3:41:22 AM
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Virologie, Vol. 10, n° 2, mars-avril 2006
brèves
150
(Flgag). Quatre des chimpanzés « NSmut » ont développé une réponse immunitaire
croisée T cellulaire rapide et massive. La réponse immunitaire apparaît dans les 2 à
4 semaines après l’injection de la souche H77, soit 10 semaines plus tôt que chez les
chimpanzés témoins. La rapidité de la réponse a permis de diminuer la charge virale
d’un facteur 100 et de limiter la virémie à une durée plus courte (1 à 7 semaines
contre 10 à 14 chez les chimpanzés témoins. Les 4 chimpanzés « NSmut » n’ont
développé aucun symptôme d’hépatite aiguë (aucune élévation des enzymes hépatiques
malgré une réaction immunitaire T cellulaire intrahépatique). L’infection a été
résolutive pour ces quatre cas. L’évolution du cinquième chimpanzé « NSmut » vers
une infection chronique serait due à l’apparition d’une mutation en I308 n’ayant pas
permis d’induire la production d’un nouveau pool de cellules T, ainsi qu’une moindre
immunisation vaccinale préalable.
Il est cependant intéressant de noter que le chimpanzé a une capacité naturelle à
résoudre les hépatites C aiguës, ce qui a été observé chez trois des chimpanzés
témoins. Ce modèle animal (le seul disponible actuellement) est donc peu propice à
l’étude d’un vaccin contre le VHC et, dans le cadre de cette étude, il y a peut-être un
biais dans l’interprétation des résultats.
Toutefois, cette étude permet de montrer que, malgré cette capacité de guérison
spontanée du modèle chimpanzé, la différence dans la rapidité de la réponse immuni-
taire T cellulaire entre les deux groupes est un point très intéressant et prometteur. En
effet, c’est le retard de la réponse immunitaire T cellulaire de l’hôte qui entraînerait le
passage à la chronicité de l’infection à VHC.
Un test d’infectiosité par la souche BK (génotype 1b) utilisée pour le vaccin lui-même
en parallèle de celui par la souche H77 (génotype 1a) aurait eu un apport complémen-
taire pour apprécier l’effi cacité du vaccin ainsi que la qualité de la réaction croisée
avec la souche hétérologue 1a (H77).
Il faut aussi se pencher sur la question de l’utilisation d’un vecteur adénovirus chez
l’homme, sur le plan éthique et sur celui des conséquences toxiques possibles. Une
étude chez le babouin a montré une toxicité aiguë liée au vecteur adénoviral seul
indépendamment du gène exprimé, ce qui n’est pas en faveur d’une utilisation d’un tel
type de vecteur chez l’homme.
Bien que l’équipe du Pr Nicosia soit très enthousiaste sur l’impact de ce travail dans
le traitement de l’hépatite C, mais aussi pour d’autres infections évoluant vers la chro-
nicité (VIH, malaria, infections à Mycobacteria tuberculosis), il faut garder un œil
critique et envisager de vérifi er ce travail sur un autre modèle animal comme les souris
humanisées.
Les auteurs ont essayé de pallier le problème d’une pré-immunité contre l’adéno-
virus de sérotype 5 (fréquent chez l’homme) en utilisant des sérotypes (6 et 24) moins
fréquents. Néanmoins, pour l’instant, il n’existe pas de vaccin basé sur des vecteurs
adénoviraux employés chez l’homme…
Références
1. Folgori A, Capone S, Ruggeri L, et al. A T-cell HCV vaccine eliciting effective immunity against hetero-
logous virus challenge in chimpanzees. Nat Med 2006 ; 12 : 190-7.
2. Capone S, Meola A, Ercole BB, et al. A novel adenovirus type 6 (Ad6)-based hepatitis C virus vector that
overcomes preexisting anti-ad5 immunity and induces potent and broad cellular immune responses in rhesus
macaques. J Virol 2006 ; 80 : 1688-99.
Delphine Fromentin
Laboratoire
de Virologie
et Inserm U635
Hôpital Henri-Mondor
jlevir_05-05.indd 150jlevir_05-05.indd 150 5/16/06 3:41:22 AM5/16/06 3:41:22 AM
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
2
100%