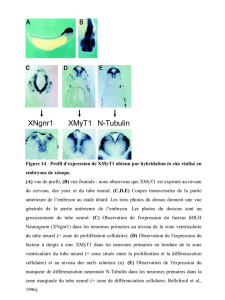
La mise en place du systme nerveux central

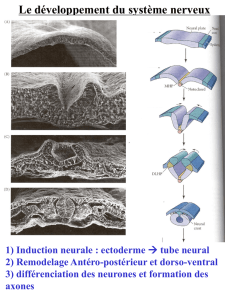
Le développement du système nerveux
2010
Pr Pierre-Simon Jouk - Département de Génétique et Procréation
Il est impossible de retracer en quelques heures l’ensemble du développement du système
nerveux central (SNC). Pour donner un ordre de grandeur de l’étendue du problème, je
donnerais 2 chiffres : 104 et 1011 ; 104 c’est le nombre de cellules de l’ectoderme qui subit
l’induction neurale primaire, c’est donc le nombre initial des cellules neurales qui au gré des
multiplications et des organisations vont donner pour l’essentiel le système nerveux définitif ;
1011, c’est le nombre total de neurones de l’encéphale du cerveau adulte. Nous ne sommes
pas habitué à manipuler de tels nombres aussi faut’ il pour se représenter les choses, utiliser
quelques analogies ; 1011 c’est aussi l’ordre de grandeur du nombre d’arbres de la forêt
amazonienne. Si l’on s’intéresse maintenant au nombre de synapses présentes dans le
système nerveux, il est du même ordre de grandeur que le nombre total de feuilles de cette
même forêt amazonienne !
Ce vaste domaine s’est donc subdivisé en une multitude de domaines secondaires au sein
desquels se développe une recherche active. Devant un tel foisonnement, il faut bien cerner
le sujet et nous nous limiterons donc à l’étude de la mise en place du plan de base du
système nerveux, c'est-à-dire à la compartimentalisation du système nerveux qui aboutit à la
mise en place des agrégats de neurones, localisés (les noyaux du système nerveux central ;
les ganglions du système nerveux périphérique) ou diffus. Nous n’envisagerons que sous
une forme conceptuelle, schématique les liaisons qui se mettent en place entre ces
différentes structures.
Il faut aussi adopter un point de vue : il est clairement embryologique. Ce point de vue est
différent des autres points de vue : neuroanatomique, neurophysiologique, éthologique,
etc… auxquels il ne se substitue pas. Son intérêt est d’être très structurant. Nous décrirons
le système nerveux à des stades ou celui-ci est encore simple. Ces structures simples une
fois stabilisées vont être dotées de caractéristiques fonctionnelles propres ; ainsi la
connaissance de l’origine embryologique d’une structure du système nerveux procure des
renseignements précieux sur son fonctionnement quand bien même la morphogénèse
tardive a considérablement complexifié le schéma de base.
Il n’est pas encore très simple d’écrire un tel cours introductif, en effet l’embryologie du
système nerveux vient de connaître de grands bouleversements ainsi d’ailleurs que la
neuroanatomie comparée. Par exemple, des entités qui paraissaient pourtant établies, celles
statufiées dans le livre de neuroanatomie comparée d’Ariens Kappers (1ère édition 1936 ;
dernière édition 1960) d’archéo, paléo et néo encéphale sont maintenant déconsidérées.
C’est le processus normal de la science, un corpus se constitue il rend compte pendant un
1

temps des données puis se fissure sous l’apparition de nouvelles données dont il ne permet
plus de rendre compte. Non seulement cet ancien corpus n’a plus de valeurs explicative,
mais il pèse dans l’émergence des nouveaux concepts nécessaires, nous en sommes là.
Deuxième élément devant conduire à la prudence, la plupart des connaissances actuelles
ont nécessairement été obtenues à partir des données de l’expérimentation animale chez les
animaux modèles de biologie du développement : la drosophile, le nématode caenorhabditis
elegans, le poisson zèbre, le xénope, la souris et nombre d’autres petits rongeurs. Il faut
donc toujours garder une certaine prudence dans les extrapolations faites depuis ces
modèles animaux vers l’être humain.
Malgré toutes ces difficultés, nous sommes à un moment où ces données fondamentales
doivent être portées à la connaissance des étudiants et des médecins, afin de ne pas laisser
se creuser le fossé entre les disciplines scientifiques et médicales. C’est ce qu’essaye de
faire ce cours introductif qui ne se substitue pas aux excellents manuels sur l’embryologie du
système nerveux. Citons sans aucune exclusive ceux de Blechschmidt, de O’Rahilly et
Müller, d’Auroux et Haegel, de Catala, de Drews, de Langman, de Larsen, etc, etc… Ces
auteurs ont insisté chacun sur des aspects différents et surtout peut être, ils ont su
développer des collaborations avec des dessinateurs pour mettre au point des
représentations bi et tridimensionnelles qui constituent un véritable apport pédagogique.
C’est a chaque étudiant de déterminer quel est celui qui lui convient le mieux, selon qu’il
privilégie tel texte, tel graphisme et surtout tel type d’interaction entre les deux.
Ces manuels résultent d’un véritable travail d’édition qu’il faut soutenir pour permettre que
cette industrie continue à s’intéresser à l’édition de ce type d’ouvrage et à leur
réactualisation.
Quelques repères chronologiques seront donnés en se référant exclusivement au
développement humain. Ils doivent être pris comme des ordres de grandeur car les données
de l’observation humaines surtout pour les stades précoces sont extrêmement limitées et
l’extrapolation des données animales est difficile.
Nous envisagerons donc après un bref rappel du schéma d’organisation de l’embryon à 18
jours de développement embryonnaire (32 jours d’aménorrhée) successivement : 1)
l’induction neurale ; 2) le développement du tube neural jusqu’au stade phylotypique; 3) la
mise en place du système nerveux périphérique ; 4) Le développement du tube neural au
delà du stade phylotypique en insistant sur le positionnement du sulcus limitans ; 5) le
développement du cortex et des noyaux gris centraux.
Rappel organisation de l’embryon humain à J18 - L’embryon est triblastique, il a une
forme ovalaire plane et mesure entre 1 et 1,5 mm dans son grand axe (figure 1).
2

nœud de Hensen
ligne primitive membrane cloacale
mésoblaste
latéral
Mésoblaste
bourgeon caudal
allantoïde
vésicule vitelline
Processus chordal
Cavité amniotique
membrane cloacale
A
B
C D
Figure 1. Schémas de l’embryon à 18 jours de développement embryonnaire. A) vue supérieure
du disque embryonnaire triblastique ; B) Coupe saggitale médiane ; C) Coupe transversale en
avant du nœud de Hensen ; D) coupe transversale en arrière du nœud de Hensen, au niveau de
la ligne primitive.
Il est situé entre la cavité amniotique et la vésicule vitelline. L’amnios qui délimite la cavité
amniotique est en continuité au niveau du bord latéral de l’embryon avec l’ectoblaste
embryonnaire. L’entoblaste vitellin qui délimite la vésicule vitelline est en continuité avec
l’entoblaste embryonnaire. Au niveau du feuillet superficiel, l’ectoblaste on distingue la ligne
primitive qui a atteint sa longueur maximale d’environ 0,5 mm. C’est à son niveau que se
sont invaginées (on utilise aussi les termes d’enroulement ou d’involution), les cellules à
l’origine de la formation de l’entoblaste et du mésoblaste embryonnaire. Les cellules du
mésoblaste embryonnaire qui se sont invaginées au niveau des berges de la ligne primitive
atteignent les bords du disque embryonnaire ou elles font leur jonction avec le mésoblaste
extra-embryonnaire. Les cellules qui se sont invaginées au niveau du nœud de Hensen,
migrent en direction rostrale pour former la plaque prochordale (structure mésenchymateuse
immédiatement caudale à la membrane bucco-pharyngée) et le processus chordal qui
conserve une structure épithéliale en doigt de gant (le terme de processus chordal est
générique pour désigner ses 3 stades successifs : canal chordal, plaque chordale et
notochorde ou chorde définitive).
3

Du fait de l’existence du processus chordal, l’organisation du mésoblaste intra-embryonnaire
n’est pas la même en arrière et en avant du nœud de Hensen.
En arrière du nœud de Hensen, le mésoblaste invaginé au niveau des berges de la ligne
primitive occupe l’espace situé entre ecto et entoblaste, ou il forme le mésoblaste du
bourgeon caudal. A l’exception de la zone de la membrane cloacale, zone d’accolement
étroit de l’ecto et de l’entoblaste au pole caudal de l’embryon.
En avant du nœud de Hensen, et en arrière de la plaque prochordale le mésoblaste est
constitué du processus chordal axial et de 2 nappes de mésoblaste latéral. Ces 2 nappes
latérales, ont migrés vers l’avant depuis les berges de la ligne primitive, de part et d’autre du
processus chordal. Elles ne fusionnent sur la ligne médiane qu’en avant de la membrane
bucco-pharyngienne.
1) L’induction neurale
C’est à 19 jours de développement embryonnaire au stade de l’embryon triblastique que
des interactions s’établissent à distance entre les cellules du mésoblaste axial (plaque
prochordale et plaque chordale), qui émettent une substance diffusible et les cellules de
l’ectoblaste sus-jacent, qui possèdent les récepteurs nécessaires et est donc compétent pour
répondre au signal diffusible. Ces cellules ectoblastiques axiales se différencient alors en
cellules neuroépithéliales de la plaque neurale. Ce processus de stimulation par un tissu
d’un autre tissu compétent qui se différencie est appelé induction, et dans ce cas particulier
d’interaction entre la plaque chordale et l’ectoblaste sus-jacent d’induction neurale primaire.
Les cellules à la jonction entre plaque neurale et ectoblaste constituent les cellules de la
crête neurale (figure 2).
4

Cellules neuroépithéliales
De la plaque neurale
Crêtes neurales
Plaque
chordale
Vésicule vitelline
Entoblaste
Ectoblaste
Amnios
Figure 2. L’induction neurale primaire. Coupe transversale de l’embryon en avant du nœud de
Hensen à 19 jours de développement embryonnaire.
Cette induction neurale primaire ne rend pas compte de la formation de la partie la plus
caudale du tube neural, en arrière du nœud de Hensen, qui provient d’un processus de
neurulation secondaire, par différenciation neurale de la partie médiane du mésoblaste du
bourgeon caudal (à ce niveau naîtra donc encore.4 paires de nerfs spinaux, 3 sacrées et une
coccygienne).
A 20 jours, la plaque neurale accentue sa plicature pour former la gouttière neurale. Dès ce
stade, on peut distinguer une portion crâniale à l’origine de l’encéphale (déjà divisé en
encéphale antérieur ou prosencéphale, moyen ou mésencéphale, et postérieur ou
rhombencéphale) et une portion caudale étroite, au niveau des somites en formation, à
l’origine de la moelle épinière.
S’il est logique d’insister sur cette interaction entre le mésoblaste axial et l’ectoblaste sus-
jacent, il ne faut pas non plus le schématiser outrancièrement. Les molécules morphogènes
qui diffusent depuis le processus chordal ont une concentration tissulaire qui décroit avec la
distance. D’autre part les autres régions embryonnaires : le mésoblaste latéral, l’entoblaste
émettent eux aussi des molécules morphogènes. Chaque territoire embryonnaire va donc
être soumis à une combinatoire propre de concentrations de morphogènes. C’est ce qui
permet d’expliquer la différenciation visible dès 19 jours entre la partie médiale de la plaque
neurale (forte concentration de morphogènes provenant du processus chordal) et les crêtes
neurales (concentration plus faible des morphogènes en provenance du processus chordal,
interactions plus fortes avec le mésoblaste latéral). Mais il ne faut pas perdre de vue que les
mécanismes inductifs à l’œuvre au niveau des régions latérales de la plaque neurale ne
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
1
/
52
100%