Gènes et Molécules du Complexe Majeur d`Histocompatibilité de

1
Le 13 Novembre 2007 RT : Caroline PETISNE
S Caillat-Zucman
Gènes et Molécules du Complexe Majeur
d’Histocompatibilité de classe 2 (CMH2)
I- Les molécules du Complexe Majeur d’Histocompatibilité
A- Les CMH en général
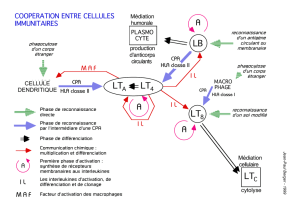
Les CMH présentent des fragments antigènes (AG) à des récepteurs du Lymphocyte T
(LT) car celui-ci, contrairement aux anticorps (AC) ou aux lymphocytes b (LB°), est
incapable de reconnaître l’AG libre.
Le récepteur du LT reconnaît un complexe CMH-peptide antigénique. Cela fournit le premier
signal d’activation du LT.
Il existe 2 catégories de LT :
- les LT CD8 qui ont une fonction cytotoxique et qui tuent les cellules pathologiques
- les LT CD4, auxiliaire ou helper, qui une fois activés, vont synthétiser des
molécules tueuses ou vont coopérer avec les LB pour la synthèse d’AC.
Ces différents LT ne reconnaissent pas les mêmes complexes CMH-peptide antigénique :
- les LT CD8 reconnaissent un complexe CMH1-peptide antigénique intracellulaire
- les LT CD8 reconnaissent un complexe CMH2-peptide antigénique extracellulaire
ou membranaire
Les CMH1 sont ubiquitaires : une cellule infectée quelle qu’elle soit peut exprimer à
sa surface les protéines virales par l’intermédiaire de CMH1 et activer ainsi les LT CD8.
Les CMH 2 sont présents au niveau de cellules spécialisées dans la présentation
antigénique les CPA, qui peuvent être de différents types :
- monocytes ou macrophages qui phagocyte l’AG et le ré-éxprime à sa surface
- LB
- Cellules dendritiques qui sont les cellules professionnelles de présentation
antigénique : elle capte l’AG, le digère et le ré-exprime à sa surface via CMH2
pour activer par la suite les LT CD4. Ces cellules possèdent des dendrites qui sont
très importantes car elles permettent d’aller chercher l’AG en périphérie et d’aller
au contact du LT.
Les CMH2 ne sont nécessaire que dur les CPA car il n’y a pas besoin de contact direct avec
les LT CD4 pour les activer.
Chez l’Homme, le CMH s’appelle HLA.
Plan :
I- Les molécules du Complexe Majeur d’Histocompatibilité
II- Les gènes du Complexe Majeur d’Histocompatibilité
III
-
HLA et Maladies

2
B- Les gènes HLA (on s’avance par rapport au II)
Il existe dans la population plus d’une centaine de gènes qui codent les molécules
HLA. Chez chacun d’entre nous les gènes sont répartis sur le bras court du chromosome 6.
Il faut savoir que les gènes des HLA de classe 1 sont situés en région télomérique et que les
gènes des HLA de classe 2 sont situés en région centromérique.
Il s’agit de gènes transmis en bloc, avec peu de remaniement. C’est ce qu’on appelle un
haplotype : chaque chromosome possède un groupe de gènes de HLA d’un des deux parents.
Comme pour les HLA de classe 1, il existe trois groupes de HLA de classe 2 : HLA DR, HLA
DQ, HLA DP.
C- Structure des HLA
HLA1
Les HLA de classe 1 sont composés une grosse chaîne lourde α transmembranaire
codée par un gène HLA1 et une chaîne β2métaglobuline, identique chez tous. La chaîne α est
composée de trois domaines α1, α2, α3. Seuls les domaines α1 et α2 forment le site de
fixation de l’AG.
Les sites de fixation peptidique des HLA1 ont une organisation physico chimique
stricte qui détermine la nature du peptide qui va venir s’y fixer. Il s’agit d’un peptide de 8 à
10 acides aminés. Ce peptide se lie de manière plus forte au niveau de résidus d’ancrage P2 et
P9.
HLA2
Les HLA de classe 2 sont composés d’une chaîne lourde α et d’une chaîne lourde β
codées à partir de chaque type de gène HLA il existe donc une chaîne HLA DRα, une HLA
DRβ, une HLA DQα, une HLA DQβ, une HLA DPα et une HLA DPβ.
Ces deux chaînes sont transmembranaires et les deux domaines les plus externes de chaque
chaîne forment le site de fixation peptidique.
Les parois de ce site sont formées d’hélice α et le plancher de feuillets β.
En ce qui concerne les sites de fixation peptidique des HLA2, les contraintes physico
chimiques sont moins strictes. La poche est plus ouverte et plus souple ce qui permet la
fixation de peptides plus longs (12 à 25 acides aminés). Mais on décrira un noyau peptidique
qui se fixe au centre de la poche au niveau de résidus d’ancrage : P1, P4 et P9.
D- Mécanisme de présentation des AG par les HLA2
1. internalisation de la protéine extracellulaire ou membranaire
2. passage dans un compartiment endolysosomal
3. dégradation de la protéine en peptides
4. rencontre avec HLA2 préformé et qui se situe dans la membrane du compartiment
endolysosomal
5. transport membranaire du complexe HLA2-peptide
6. activation LT CD4

3
II- Les gènes du Complexe d’Histocompatibilité Majeur
A- Polymorphismes HLA
Définition
Un polymorphisme est une variation de séquence d'un gène dans une population.
Un gène est considéré comme polymorphe si il existe au moins deux allèles à une
fréquence égale ou supérieure à 1%.
Au niveau des HLA
Au niveau du gène HLA, ces variations vont entraîner une variation de la nature
physicochimique de la molécule. Cela retentit sur la nature du peptide antigénique fixé et
présenté ou autrement dit sur la capacité de fixation d’un peptide donné.
Le polymorphisme est très important mais est distribué de manière intelligente sur le gène :
il ne touche que les parties du gènes codant pour les domaines correspondants au site de
fixation. D’où le retentissement direct sur la nature du peptide qui se fixe.
On l’a vu, les polymorphismes sont très importants. En effet, il existe 400 allèles HLA DR,
100 allèles HLA DQ et 100 allèles HLA DP.
Ces chiffres sont donnés au niveau d’une population mais chez un individu, en général
hétérozygote, il n’y a bien entendu que 2 allèles différents.
Intérêt polymorphisme
Le polymorphisme est intéressant surtout au niveau de la population générale : il
augmente les chance dans la population qu’on ait au moins un allèle capable de lutter contre
au moins un agent pathogène. Ce qui revient à dire que face aux agents pathogènes, le
polymorphisme induit la survie de l’espèce.
Au niveau d’un individu il y a peu de HLA différents donc chaque allèle doit être capable de
fixer le plus grand nombre de peptides différents. Mais certains individus seront incapables de
répondre à une protéine donnée par une bonne réponse immunitaire.
Dans une population donnée et face à une AG donné, il y a des bons et des mauvais
/non répondeurs : les bons répondeurs sont capables de déclancher un réponse adaptée à la
présence de l’AG alors que les non répondeurs en seront incapables.
En thérapeutique, cela est très important : il faut tenir compte des polymorphismes au
sein d’une population pour fabriquer un vaccin. Le vaccin doit permettre de déclencher une
réponse immunitaire adaptée chez un maximum de personne.
Etude des polymorphismes
L’étude des polymorphismes se fait à 2 niveaux :
- au niveau protéique (avant, peu précis)
- au niveau génomique (maintenant, très précis) se base sur l’étude des séquences

4
B- Le codage
Pour HLA DQ : il y a deux façons de coder les gènes : soit c’est un codage en cis, soit c’est
un codage en trans.
Le codage en cis signifie que les chaînes α et β sont codées par les gènes du même
chromosome 6.
Dans un codage en trans, les chaînes α et β sont codées par les gènes des 2 chromosomes 6.
Au final on pourra avoir plusieurs combinaisons pour la formation du site de fixation :
- Domaines α1 et β1 paternels
- Domaines α1 et β1 maternels
- Domaine α1 paternel et domaine β1 maternel
- Domaine α1 maternel et domaine β1 paternel
Pour HLA DR, la chaîne α est identique chez tout le monde ce qui diminue le nombre de
possibilités de combinaison
Pour HLA DP on ne sait pas trop comment ça marche.
C- Déséquilibre de liaison
Le déséquilibre de liaison se caractérise par le fait qu’on retrouve chez un individu donné
une combinaison de certains allèles à différents locus plus fréquente que ne le voudrait le
hasard si la population était équilibrée.
Ex : haplotype A1-B8-DR3 : la fréquence attendue est de 0,0098
la fréquence observée est de 0,071
L’haplotype est alors dit conservé ou ancestral, il y a eu un avantage sélectif au cours de
l’évolution de l’espèce qui a fait que cet haplotype est plus fréquent.
Il y a alors un enrichissement d’allèles dans certaines populations en fonction des conditions
de vie.
D- Organisation génomique du gène de HLA2
Il s’agit d’une organisation classique en Introns-Exons : chaque exon code pour un domaine
de la chaîne de HLA et au départ la 1
er
exon est un exon de signalisation qui sera clivé dans le
Golgi.
Il existe deux types d’expression de ces gènes :
- expression constitutive dans les macrophages, cellules dendritiques….
- expression inductible dans certaines cellules en certaines circonstances (ex des
cellules épithéliales)
Ces gènes doivent être régulés pour n’être exprimés que dans CPA. Les mécanismes de
régulations ont été découverts lors de l’étude de bébés qui avaient un déficit immunitaire : ces
bébés n’exprimaient pas HLA2 du fait d’une mutation sur le gêne d’un facteur de
transcription.
Ces mécanismes de régulations sont complexes du au fait qu’il y a plusieurs facteurs
nucléaires de transcription qui s’associent et se fixent à différente endroit du promoteur du
gène HLA2.
Ex : C2T1
Niveaux supplémentaires
de polymorphisme
haplotype conservé

5
III- HLA et Maladies
Certaines maladies auto-immunes surviennent préférentiellement chez des sujets portant
certains allèles HLA : c’est la prédisposition génétique.
Ex : l’allèle HLA B27 est associé à la spondylarthrite ankylosante : on suppose que cela mène
à la reconnaissance d’un AG du soi et donc à une destruction des cellules du soi.
Si on porte l’allèle HLA B27, les risques de développer une spondylarthrite ankylosante sont
multipliés par 100.
Le risque relatif c’est la « chance » qu’un sujet exprimant l’allèle X développe la maladie
associée : si il est supérieur à 1 on parle de prédisposition,
si il est inférieur à 1 on parle de protection.
Ex : l’allèle HLA DQ2 est associé à la maladie coeliaque qui est une intolérance au gluten :
certains peptides d’une région particulière du gluten se fixent avec une forte affinité sur HLA
DQ2 ce qui va activer les LT CD4. Ces derniers vont synthétiser un interféron (IFN) qui
entraîne la destruction des entérocytes. Ceci provoque une malabsorption digestive.
Fini
La ronéo a été faite à partir de mes notes donc désolée si tout n’y est pas!!!
Par ailleurs, je me suis permis de changer la place de 2 paragraphes (mécanismes de
présentation de l’AG et étude des polymorphisme) par rapport au cours j’espère que ça ne
vous dérangera pas : c’était plus simple pour le plan et j’ai trouvé que c’était plus fluide
comme ça !
Bon courage !
1
/
5
100%