programme de colle 19

Colles
Lycée Hoche – BCSPT1A – A. Guillerand
Colles 19 Page 1
Programme de colles n°19 – du 6 au 10 mars 2017
Thermodynamique
Chapitre 1 : Description des différents états de la matière
Chapitre 2 : Éléments de statique des fluides
Savoirs
Savoir-faire
Équation différentielle fondamentale de la statique des
fluides.
Équation de la statique des fluides incompressibles.
Modèle de l’atmosphère isotherme.
Appliquer l’équation fondamentale de la statique des
fluides dans le cas des fluides incompressibles.
Appliquer l’équation fondamentale de la statique des
fluides dans le cas des fluides compressibles.
Chapitre 3 : Changements d’état du corps pur
I. Phénomènes de changements d’états
1. Les différents changements d’états
2. Expérience de changement d’état à pression constante
3. Expérience de changement d’état à température constante
4. Notion de vapeur saturante
5. Évaporation et ébullition
6. Aspects énergétiques
7. Retard à la solidification et à l’ébullition
II. Diagramme de phase température – pression
1. Allure du diagramme de phases pression – température dans la majorité des cas : exemple du diagramme du
dioxyde de carbone
2. Cas particulier du diagramme de l’eau
3. Notion de variance
4. Cas particulier de l’allotropie
Savoirs
Savoir-faire
Allure du diagramme de phase des
corps purs et cas particulier de l’eau
(noms des courbes, points particuliers,
etc.).
Notion de pression de vapeur saturante.
Notion de variance.
Notion d’enthalpie de changement de
phase.
Tracer un diagramme de phase ( ) et ( )
Tracer une courbe d’analyse thermique à partir du diagramme de phase.
Tracer une courbe de variation de pression à température constante à partir
du diagramme de phase.
Utiliser la notion de pression de vapeur saturante pour déterminer l’état de
vapeur sèche ou de vapeur saturante d’un système.
Savoir calculer un transfert d’énergie lors d’un changement de
phase.
Pour les colleurs : pas de diagramme de Clapeyron pour l’instant
Structure de la matière
Chapitre 5 : Interactions intermoléculaires

Colles
Lycée Hoche – BCSPT1A – A. Guillerand
Colles 19 Page 2
Thermodynamique
Chapitre 5 : Étude des systèmes siège de réactions d’oxydation
I. Équilibre d’oxydoréduction
1. Couple oxydant-réducteur
2. Nombre ou degré d’oxydation
3. Équation de réaction d’oxydoréduction
4. Couples d’oxydoréduction de l’eau
II. Prévision des réactions d’oxydoréduction
1. Potentiel standard d’oxydoréduction
2. Constante standard d’équilibre d’une réaction d’oxydoréduction
III. Pile électrochimique
1. Exemple de la pile Daniel
2. Principe général et vocabulaire
3. Prévision du sens de fonctionnement d’une pile
Savoirs
Savoir-faire
Définitions : oxydant, réducteur, oxydation,
réduction, nombre d’oxydation.
Notion de potentiel standard.
Lien entre la constante standard de réaction
d’oxydoréduction et les potentiels standard
des couples.
Définitions : demi-pile, électrode, pile,
anode, cathode.
Écrire les échanges électroniques de différents couples rédox : demi-
équations et équation bilan.
Déterminer les nombres d’oxydations d’espèce chimique.
Utiliser l’expression de la constante d’équilibre en fonction des
potentiels standard.
Savoir utiliser l’échelle des potentiels standard.
Déterminer la composition à l’équilibre dans le cas d’une unique
réaction prépondérante.
Remarque pour les colleurs : la formule de Nernst n’est pas au
programme de BCPST1
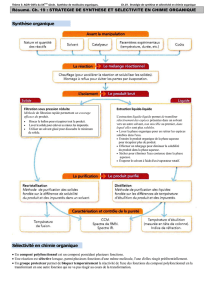
Chimie organique
Chapitre 4 : Solvant et acido-basicité en chimie organique
I. Rôle du solvant en chimie organique
1. Rôle du solvant lors d’une synthèse organique
2. Rôle du solvant lors d’une extraction
3. Catégorie de solvants
II. Acido-basicité en chimie organique
1. Solvant amphiprotique
2. Échelle de généralisée
3. Synthèses quantitatives d’acides ou de bases, forts dans l’eau, en chimie organique
4. Analyse de la force des acides en chimie organique
5. Cas particulier de la formation d’un ion alcoolate dans l’alcool correspondant
6. Cas particulier de l’acidité en d’un carbonyle : équilibre céto-énolique
Savoir
Savoir-faire
Rôle d’un solvant (notion de solvatation et de dissociation
dans le cas des solides ioniques).
Reconnaître un solvant polaire ou apolaire, protique ou
aprotique.
Notion d’échelle de généralisée : utilisation de solvants
autre que l’eau pour obtenir des bases plus fortes que et
des acides plus forts que .
Connaître le caractère acide ou basique de : acide
carboxylique, alcool, amine, H en α de groupe
électroattracteur. Connaître l’ordre de grandeur des des
couples concernés (en sachant les explications).
Connaître les trois méthodes de formation d’un ion alcoolate.
Équilibre céto-énolique + mécanisme en milieu acide ou
basique.
Savoir expliquer le principe de la méthode de
l’extraction liquide-liquide.
Savoir justifier/évaluer le d’un couple A/B en
chimie organique (en analysant les effets
mésomères ou inductifs).
Savoir proposer des conditions opératoires adaptées
pour protoner ou déprotoner une espèce.
Savoir écrire les mécanismes de réactions acido-
basiques en chimie organique.

Colles
Lycée Hoche – BCSPT1A – A. Guillerand
Colles 19 Page 3
Compétences générales évaluées
S’approprier
Comprendre ce qui est attendu dans un énoncé
Extraire les informations d’un énoncé
Modéliser une situation concrète
Relier le problème à une situation modèle connue
Analyser
Identifier les domaines de la discipline, les lois, les grandeurs physiques ou chimiques à
utiliser
Décomposer le problème posé en des problèmes plus simples afin de construire
l’ensemble du raisonnement avant de commencer
Savoir exploiter des informations sous formes diverses (valeurs numériques, graphique,
tableau, spectre, etc.)
Formuler une hypothèse, construire un modèle
Définir le système d’étude
Réaliser
Construire un raisonnement scientifique logique
Maîtriser ses connaissances
Réinvestir ses connaissances
Savoir mettre en place des équations mathématiques pour résoudre un problème physique
ou chimique
Savoir mener efficacement les calculs analytiques
Savoir déterminer une expression littérale
Savoir effectuer des applications numériques correctes (conversion d’unités si besoin),
avec le bon nombre de chiffres significatifs
Valider
Vérifier l’homogénéité des formules lors d’un calcul
S’assurer que l’on a répondu à la question posée
Exercer son esprit critique sur la pertinence d’un résultat (ordre de grandeur, comparaison
avec des résultats connus, précision d’une mesure…), d’une hypothèse, d’un modèle
Interpréter des résultats
Valider ou invalider une hypothèse, une information, une loi…
Confronter un modèle au réel, confronter un modèle mathématique à des résultats
expérimentaux (identification du graphe à tracer, régression, …)
Communiquer
Faire preuve d’initiative
Demander une aide pertinente
S’exprimer de manière claire, concise et avec assurance
Utiliser le tableau de manière claire et lisible
Utiliser un vocabulaire scientifique adapté et rigoureux
Réagir face à une situation difficile (erreurs dans le raisonnement, erreurs de calcul, etc.)
Tenir compte des aides et des commentaires du correcteur

Colles
Lycée Hoche – BCSPT1A – A. Guillerand
Colles 19 Page 4
Compte-rendu de la colle
Interrogateur(trice) : groupe :
Nom
Description du sujet, commentaires et note
1
/
4
100%