Les biofilms - Journée Technique BIOFILM 2016

Les biofilms, un problème récurrent
dans les environnements de production
Christine PISSAVIN
IUT de Saint-Brieuc
Département Génie Biologique
Journée Technique-Prévention des Biofilms-Ploufragan- 8 Décembre 2016

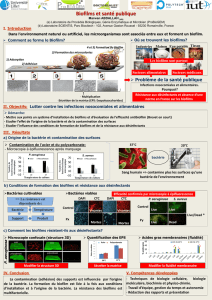
Les biofilms
Communautés microbiennes complexes et organisées persistant sur les surfaces malgré les
procédures de nettoyage et désinfection

Où trouve-t-on les biofilms en IAA?
•Ateliers (viandes, poissons, fromages, etc)
–Équipements
–Murs, sols
–Aération, air conditionné, écoulement des eaux usées, siphons
•Équipements fermés (produits laitiers, etc.)
–Circuit de fabrication
–Conditionnement
–Circuit de nettoyage
•Cuisines collectives ou non
–Surfaces en contact direct ou non avec les aliments
–+/- Éponges, torchons

Biofilms dans l’environnement
Planche de découpe
Tapis de convoyage
(Staphylococcus sciuri) photo G.
Bourdin
Biofilms sur feuille de salade
Bacillus cereus sur inox

Formation d’un biofilm
Adhésion Division
cellulaire
Aggrégats
Formation
du Biofilm
Maturation
du Biofilm
Interactions
physicochimiques
Flux : air, liquide
Film
conditionnant
Synthèse d’EPS
(polysaccharides, protéines, ADNe…)
Dispersion
Environnement
Aliments
Expression gènes
de stress
Erosion du
Biofilm
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%