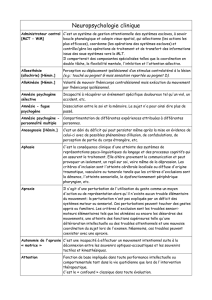
Effets cétogènes de produits alimentaires dérivés de li

UniversitédeSherbrooke
Élévationaigüedelacétonémie:
Effetscétogènesdeproduitsalimentairesdérivésdel’huiledenoixdecocoet
influenced’unecombinaisonavecdel’exercicedetypeaérobie
Par
CamilleVandenberghe
DépartementdePharmacologieetPhysiologie
MémoireprésentéàlaFacultédemédecineetdessciencesdelasanté
envuedel’obtentiondugradedemaîtreèssciences(M.Sc.)
enPhysiologie
Sherbrooke,Québec,Canada
Mars,2017
Membresdujuryd’évaluation:
PrStephenCunnane,Départementdepharmacologie-physiologie
PreIsabelleDionne,Facultédessciencesdel’activitéphysique
PreMélaniePlourde,Départementdepharmacologie-physiologie
PreEléonorRiesco,Facultédessciencesdel’activitéphysique
©CamilleVandenberghe,2017

II

III
Élévationaigüedelacétonémie:
Effetscétogènesdeproduitsalimentairesdérivésdel’huiledenoixdecocoet
influenced’unecombinaisonavecdel’exercicedetypeaérobie
Par
CamilleVandenberghe
DépartementPharmacologie-Physiologie
MémoireprésentéàlaFacultédemédecineetdessciencesdelasantéenvuede
l’obtentiondudiplômedemaîtreèssciences(M.Sc.)enPhysiologie,Facultéde
médecineetdessciencesdelasanté,UniversitédeSherbrooke,Sherbrooke,Québec,
Canada,J1H5N4
Depuis maintenant plus de 30 ans, il est reconnu qu’au début de la maladie
d’Alzheimer, le cerveau utilise moins bien le glucose, son principal carburant.
Cependant, ce problème énergétique précoce dans la maladie semblerait limité au
glucoseetneconcerneraitpasunautrecarburant,celui-cidérivédesgras,lescétones.
Ces dernièressont produites par le corps après un exercice physique d’intensité
modérée. Leur production est également stimulée avec la prise de suppléments
alimentaires à base d’huile de noix de coco, un aliment riche en triglycérides de
moyennes chaînes (MCT). La capture des cétones au cerveau augmente
proportionnellementàleurconcentrationplasmatique.Ainsi,desconditionsélevantla
cétonémie augmentent aussi la capture cérébrale des cétones. Par conséquent,
l’élévation de l’apport en cétones pourrait constituer une approche novatrice qui
permettrait de potentiellement ralentir le développement de la maladie d’Alzheimer.
Notre objectif général était d’optimiser le type de supplément MCT à utiliser afin
d’élever la cétonémie de manière aigüe et, en second lieu, d’employer ce dernier en
combinaisonavecunesecondestratégiecétogène,l’exercicephysiquedetypeaérobie
(EA). Lors de la première phase de ce projet, l’effet cétogène de différents produits
alimentairesdérivantdel’huiledenoixdecoco(acidecaprylique[C8],acidecaproïque
[C10], mélange de MCT typique [C8+C10]) était comparé chez 9 participants jeunes
sains.Deséchantillonssanguinsétaientrécoltéstoutesles30minpendant8h.Lorsde
lasecondephase,lepotentielcétogènedelacombinaisond’EAàunesupplémentation
MCT était évalué chez 10 femmes âgées saines pendant 5 jours. Les cétones
plasmatiquessouscesdifférentesconditionsétaientmesurées.Lorsdecetteétude,le
C8étaitleproduitlepluscétogènetestésuividusupplémentC8+C10.L’huiledenoixde
cocon’apasinduitunecétonémieplusélevéequ’un8hsansMCT.Deplus,l’ajoutde5
jours d’EA a potentialisé la cétonémie observée suite à la prise de MCT C8+C10seul.
Ainsi, la combinaison de stratégies cétogènes, tant au niveau de la diversité des
molécules utilisées ou des stratégies cétogènes employées, permet d’augmenter la
présencedecétonesdanslesang.
Motsclé:Cétonémie,triglycéridesdemoyenneschaînes,exercicephysique,huilede
noixdecoco,acidecaprylique,acidecaprique

IV
SUMMARY
Acuteplasmaketonestimulation:
Ketogeniceffectsofproductsderivedfromcoconutoilandinfluenceofacombination
withaerobicexercise
Brain glucose consumption deteriorates with age, a situation that worsens with the
onset of Alzheimer's disease. However, this early energy problem in the disease is
limited to glucose and does not affect brain ketone uptake. Ketones are the main
alternative fuel for the brain when glucose concentrations are decreased. They are
producedendogenouslyaftermoderateaerobicexercise(AE)orwithamediumchain
triglyceride(MCT)exogenoussupplement.Ketonebrainuptakeincreasesinproportion
totheirplasmaconcentration.Thus,providingadailyketogenicfuelcouldhelpsupport
brainenergyneedsduringaging.OuraimwastooptimizethetypeofMCTtouseina
ketogenic supplementation and to combine this supplement with another ketogenic
strategy, AE. In the first phase of this project, the acute ketogenic effect of products
derived from coconut oil was compared. Nine healthy adults took various MCT
supplements (coconut oil, caprylic acid [C8], capric acid [C10], classic MCT mix
[C8+C10]).Bloodwassampledevery30minover8h.Inthesecondphase,weevaluated
theacuteketogenicpotentialofthecombinationofAEandMCTsupplementation.Ten
healthyolderwomentookC8+C10MCTsupplementfor5dayscombinedwitha5-days
AE program. Automated spectrophotometric assays where used to measure plasma
ketonesunderthesedifferentconditions.Ourresultsshowthatinthis8hexperimental
design,C8wasthemostketogenicMCTfollowedbyC8+C10.Coconutoilalonedidnot
induce more net ketosis than an 8 h visit with no added MCT. Furthermore, the
combinationofAEandMCTsupplementationenhancedtheketogenicresponseover4h
compared to the control day. Thus, the combination of ketogenic strategies, both in
terms of the diversity of the molecules or the ketogenic strategy employed, makes it
possibletoincreasethepresenceofketonesintheblood.
Keywords:Plasmaketone,medium-chaintriglycerides,exercise,coconutoil,caprylic
acid,capricacid

V
Unsavantsaitqu’ilnepeutpas
répondrescientifiquementaupourquoi.
Ilselimiteaucomment.
-Eric-EmmanuelSchmitt
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
1
/
81
100%