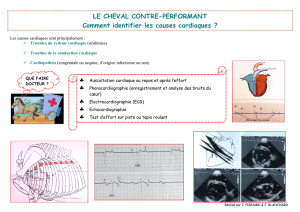
Catheter d`injection intra-cardiaque Helix et cathéter guide

Page1/2
AVISURGENTDESÉCURITÉSURLETERRAINémisle:15février2017
Produitsconcernés:Numérode
modèle
Numérodelot
CathéterdeperfusionhélicoïdaldeBioCardia00953L01347,01362
CathéterguideuniverselàemboutorientableBioCardiaMorph0089501309
Notification:BioCardiaarévisélemoded'emploi(exemplaireci‐joint)afind’incluredesconsignespour
clarifierlapriseenchargedespatientsquiprésententunévènementindésirablepotentiellementliéà
l’utilisationdesproduitsmentionnésci‐dessus.Letexteexistantdumoded’emploiconcernantles
évènementsindésirablespotentielsestprésentéci‐dessousetlesmodificationssontidentifiéesparun
texterougeencaractèresgras:
Effetsindésirablespotentielspouvantentraîneruneblessuregraveouledécès
Perforationcardiaqueprovoquantunépanchementpéricardiqueouunetamponnade;
Perforationvasculaire;
Emboliegazeuse,athéroembolieouthromboembolie;
Lésionsdesvaisseauxoudesstructurescardiaques,ycomprisdesvalvulescardiaques;
Arythmiesinstables,ycomprislatachycardieventriculaire,labradycardie,lafibrillationventriculaire
ouatrialeoulebloccardiaque;
Infarctusdumyocarde;
AVCet
Infection.
Entenantcomptedel’évaluationcliniquedupatientetdevotreconnaissancedesnormesdesoins,ilest
recommandéd'arrêterl’interventionsil’undesévènementsindésirablespotentielsquiprécèdentest
soupçonnéousilepatientnécessiteuneinterventionmédicalepourremédierautroubledesanté.
Descriptionduproblème:nousvousfournissonscesconsignesenraisond’uneinterventionaucours
delaquelleunpatientaprésentétroisépisodesdetachyarythmieventriculaire–l’unliéàlaposeinitiale
dufil‐guidedansleventriculeetlesdeuxautresàl’utilisationducathéterdeperfusionhélicoïdalavec
guideMorphlorsdupositionnementdansleventriculegauche.Lesdeuxderniersépisodesont
nécessitéunedéfibrillationexternepourrétablirlerythmesinusal.
Lepatientn’apassubidepréjudice,maisletraitementaétéinterrompuavantquetouteslesinjections
prévuesn’aientpuêtreréalisées.
Aucuneautremodificationn’aétéapportéeauxproduitsconcernésetcetavisn’apasétépréparéen
réponseàunedéfaillanceouunmauvaisfonctionnementdeceux‐ci.
Bienquel’expériencedupatientaitétéliéeàunévènementindésirablepréalablementidentifié,les
modificationsapportéesaumoded’emploiconcernenttouslesévènementsindésirablespotentiels
pouvantseproduiresuiteàl’utilisationdesproduitsdeBioCardia.
Aucunélémentdumoded’emploinedoitremplacerlemeilleurjugementcliniquedumédecintraitant
encequiconcernelesnormesdesoinsactuellespourl’étatdesantédupatientenquestion.
Portée:cettenotifications’appliqueàtouslesproduitsdeBioCardiaquisontindiquéspourêtreutilisés
danslescavitéscardiaques.Cesconsignessontprobablementapplicablesàtouslesdispositifsquisont
placésdanslescavitéscardiaquesetidentifientl’arythmiecommerisquepotentiel.

Page2/2
Voscommentaires:noussouhaitonsrecueillirvoscommentairesconcernantcesmodifications,pour
savoirsilesinstructionssontclairesousileproblèmepourraitêtremieuxcommuniquéauxfuturs
utilisateursdenosproduits.
Mesuresrequises:aucunemesuren’estrequiseconcernantlesproduitsquevousavezdéjà
commandéspourvotreutilisation.L’inventaireseramodifiépourinclurelemoded’emploimisàjour
parl’équiped’assistanceBioCardia,quiseraprésenteaumomentdelaprochaineutilisationdes
dispositifs,commestipulédansnotreAccordd'assistanceclinique.
UnvisiteurcliniqueBioCardiapourraitvouscontacteravantcelaafindediscuterdecetavisetde
répondreàvosquestionséventuelles.
Nousvousprionsdeconfirmerréceptiondecetavisenremplissantleformulaireaubasdecettepage,
enlesignantetenlerenvoyantparfaxousousformededocumentnumériséauformatPDFàl’une
despersonnescontactci‐dessous.
Personnescontact:n’hésitezpasànouscontactersivousavezdesquestionsconcernantcette
notification.
DrEricDuckers,MDPhDFESC
ChiefMedicalOfficer
BioCardia,Inc.
125ShorewayRoad,SuiteB
SanCarlos,CA94070,États‐Unis
Tél.:+1650226‐0120
Fax:+1650631‐3731
AndyMackenzie
VPRegulatory
BioCardia,Inc.
125ShorewayRoad,SuiteB
SanCarlos,CA94070,États‐Unis
+1650226‐0120
Fax:+1650631‐3731
Lesoussignéconfirmequecetavisaététransmisauxagencesderéglementationcompétentes.
AndyMackenzie
************************************************************
Confirmationderéceptionetderemplacementdumoded’emploi
Établissement:
Nom:
Signature:Date
Questionsoucommentaires:
1
/
2
100%