1. DENOMINATION DU MEDICAMENT Desmopressine

Résumé des caractéristiques du produit
1. DENOMINATION DU MEDICAMENT
Desmopressine Ferring 0,2 mg comprimés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Desmopressine acétate 0,2 mg équiv. à Desmopressine (base libre) 0,178 mg
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimés
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Enurésie nocturne de l'enfant au dessus de 5 ans : traitement symptomatique après exclusion d'une
quelconque pathologie organique sous-jacente.
Sur base des données actuellement disponibles, on peut distinguer différents types d'énurésie nocturne
:Desmopressine Ferring est principalement indiqué chez les patients énurétiques présentant un profil de
concentration urinaire de 24 heures anormal (Type I) : la diurèse nocturne est supérieure à la capacité
vésicale pour l'âge, calculée selon la formule [(âge + 2) x 30 ml] et confirmée par le volume vésical
mesuré objectivement. Cette formule est utilisable jusqu'à l'âge de 14 ans, après quoi on considère que la
capacité vésicale maximale est atteinte.
−Pour déterminer la diurèse nocturne, l'urine est collectée à 4 intervalles réguliers. On propose aux
parents de réveiller l'enfant 4 fois au cours d'une même nuit et de le faire uriner. Par exemple, si
l'enfant se couche vers 20 heures, on le réveillera à 23 heures, 2 heures, 5 heures et 8 heures. L'urine
est chaque fois récoltée dans un récipient gradué afin de pouvoir en mesurer le volume.
−Pour mesurer le volume vésical, on laisse l'enfant boire autant qu'il le souhaite pendant un jour et on
lui demande d'attendre aussi longtemps que possible avant d'uriner; le volume urinaire est alors
mesuré chaque fois à l'aide d'un récipient gradué.
S'il apparaît que le volume urinaire nocturne est supérieur à la capacité vésicale pour l'âge et au volume
vésical maximal, il est probable qu'il s'agisse d'un trouble de rythme nycthéméral de la diurèse.
Desmopressine Ferring peuvt également être utilisé dans l'énurésie idiopathique encore appelée énurésie
"de type cognitif" (Type IV) dans laquelle tous les examens de dépistage sont normaux mais dans
laquelle il existe un retard au plan de la maturation et du contrôle cognitifs de la vessie.
Dans ce type d'énurésie, le training cognitif est le traitement de premier choix :
−schéma d'hydratation et de miction fixe pendant la journée,
−stimulation positive,
−méthode du calendrier,
−apprentissage de la continence urinaire nocturne,
−alarme dès que l'enfant ne mouille plus son lit 2 à 3 nuits par semaine.
Si les résultats sont insuffisants ou si les progrès sont trop lents, on peut administrer Desmopressine
Ferring comme traitement adjuvant dans ce type d'énurésie.

Résumé des caractéristiques du produit
Les types d'énurésie décrits ci-dessus (Type I et IV) répondent bien à un traitement par Desmopressine
Ferring, alors que chez les patients présentant un trouble de la fonction vésicale ou une énurésie
psychologique primaire (rare) - Type II et III - un traitement spécifiquement axé sur ce type d'énurésie est
indiqué.
Après 3 mois de traitement par Desmopressine Ferring, on réévaluera chaque fois la nécessité de
poursuivre le traitement. Pour ce faire, on réduira progressivement les doses pour voir si l'énurésie
réapparaît. Une minorité de patients seulement devront recevoir un traitement de longue durée et/ou
resteront, en raison de leur substrat physiologique, dépendants d'une dose réduite de Desmopressine
Ferring.
Traitement du diabète insipide d'origine centrale et sensible à la vasopressine et du syndrome de polyurie
et de polydipsie après une intervention chirurgicale dans la zone hypophysaire.
Traitement symptomatique de la nycturie incommodante associée à une polyurie nocturne, c'est-à-dire en
cas de production nocturne d'urine qui dépasse la capacité de la vessie.
4.2. Posologie et mode d'administration
Enurésie nocturne
La posologie doit être adaptée en fonction du patient sur la base de la diurèse de 24 heures et de
l'osmolalité urinaire. Le traitement commence par une dose d'essai.
Pour les enfants et les adultes, on administre une dose d'essai de 0,2 mg le soir, une heure avant le
coucher. La posologie est adaptée individuellement en fonction des résultats pendant la première semaine.
La posologie standard est de 0,2-0,4 mg/jour.
On maintient le traitement pendant au moins 3 mois, éventuellement associé à des méthodes de
rééducation.
A intervalles réguliers (au moins tous les 3 mois), on cherche à savoir s'il est nécessaire de poursuivre le
traitement. Pour cela, on réduit progressivement le traitement (par exemple, si la posologie est de 0,4 mg
= 2 comprimés par jour, on traite d'abord pendant une semaine avec 0,2 mg = 1 comprimé par jour (1
comprimé), ensuite avec 0,1 mg = 1/2 comprimé/jour, avant d'arrêter le traitement) et on voit si l'énurésie
réapparaît. Le schéma de réduction de la dose est laissé à l'appréciation du médecin en fonction du cas et
de la réponse obtenue.
Une minorité des patients doivent cependant recevoir un traitement de plus longue durée et/ou
continueront à rester dépendants de Desmopressine Ferring, en raison de leur propre constitution
physiologique.
Il est conseillé de ne pas trop boire le soir avant la prise de Desmopressine Ferring(voir précautions
particulières).
Diabète insipide central
La posologie doit être adaptée en fonction du patient sur la base de la diurèse de 24 heures et de
l'osmolalité urinaire. Le traitement commence par une dose d'essai.
Pour les enfants et les adultes, on propose une dose d'essai de 0,1 mg (1/2 comprimé) trois fois par jour, et
cette dose sera adaptée en fonction de la réponse.
En général, la dose journalière varie entre 0,2 et 1,2 mg. Pour la plupart des patients, la posologie
optimale est de 0,1-0,2 mg trois fois par jour.
Lorsqu'il se produit des symptômes de rétention hydrique/hyponatrémie, le traitement doit être
interrompu et la posologie doit être adaptée.
Nycturie

Résumé des caractéristiques du produit
La dose initiale recommandée est de 0,1 mg (1/2 comprimé) au moment du coucher. Si cette dose s'avère
insuffisamment efficace après une semaine, elle peut être portée à 0,2 mg, puis à 0,4 mg, en adaptant la
dose par palier hebdomadaire. Il convient de surveiller la rétention liquidienne.
Chez les patients atteints de nycturie, il faut utiliser une fiche fréquence/volume au moins 2 jours avant le
début du traitement pour poser le diagnostic de polyurie nocturne.
Une production nocturne d'urine qui dépasse la capacité fonctionnelle de la vessie ou qui dépasse un tiers
de la production de 24 heures est considérée comme étant une polyurie nocturne.
La prise d'aliments peut réduire l'intensité et la durée de l'effet antidiurétique de faibles doses de
desmopressine (voir 4.5).
Il n'est pas recommandé d'initier un traitement chez des patients âgés. Si les médecins décident d'instaurer
un traitement par desmopressine chez ces patients, il convient alors de mesurer le sodium sérique avant le
début du traitement, 3 jours après le début du traitement ou après l'augmentation de la posologie, et à
d'autres moments du traitement lorsque le médecin traitant le juge utile.
Lorsqu'il se produit des symptômes de rétention hydrique et/ou d'hyponatrémie (céphalée,
nausées/vomissements, gain de poids et, dans les cas graves, convulsions), le traitement doit être
interrompu jusqu'à ce que le patient soit complètement rétabli. Lorsqu'on reprend le traitement, il convient
de surveiller étroitement la rétention liquidienne (voir 4.4).
Lorsqu'on n'a obtenu aucun résultat clinique dans les 4 semaines qui suivent l'augmentation appropriée de
la dose, le traitement doit être arrêté.
4.3. Contre-indications
−Polydipsie normale et psychogène (entraînant une production d'urine > 40 ml/kg/24 h.).
−Insuffisance cardiaque connue ou suspectée et autres circonstances nécessitant un traitement par
diurétiques.
−Insuffisance rénale modérée à sévère (clairance de la créatinine < 50 ml/min).
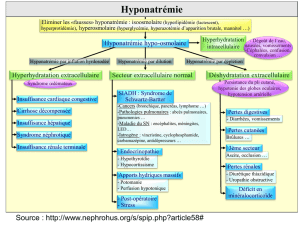
−Hyponatrémie connue ou prédisposition à l'hyponatrémie.
−SIADH (syndrome de sécrétion inappropriée d'ADH).
−Allergie connue à la substance active ou à l'un des excipients.
4.4. Mises en garde spéciales et précautions d’emploi
Mises en garde spéciales
Lorsqu'on utilise Desmopressine Ferring, la prise de liquide doit être limitée au minimum à partir de 1
heure avant jusqu'à 8 heures après l'administration du produit.
Un traitement sans réduction simultanée de la consommation de liquide peut entraîner une rétention d'eau
et/ou une hyponatrémie avec ou sans signes d'alarme ou symptômes (céphalées, nausées/vomissements,
prise de poids et, dans des cas graves, convulsions).
En cas de gain de poids progressif, de diminution du taux sérique de sodium à < 130 mmol/l ou
d'osmolalité plasmatique < 270 mOsm/kg de poids corporel, la consommation liquidienne doit être
limitée de manière drastique et l'administration de Desmopressine Ferring doit être arrêtée.
Précautions
Un contrôle recherchant une dysfonction vésicale sévère et une obstruction des voies urinaires doit avoir
lieu avant le début du traitement.
Les patients âgés et les patients présentant un faible taux sérique de sodium peuvent avoir un risque élevé
d'hyponatrémie.
Des précautions doivent être prises dans les cas suivants afin de prévenir une hyponatrémie, notamment
un contrôle soigneux de la restriction liquidienne et un contrôle plus fréquent du taux sérique de sodium:

Résumé des caractéristiques du produit
−patients âgés fragiles,
−cas de traitement simultané par des médicaments dont on sait qu'ils induisent un SIADH, tels
qu'antidépresseurs tricycliques, chlorpropamide et oxcarbazépine, inhibiteurs sélectifs de la recapture
de la sérotonine, chlorpromazine et carbamazépine (voir 4.5),
−en cas de traitement simultané par AINS,
−patients en postopératoire auxquels on administre un liquide intraveineux hypotonique,
−patients avec antécédents de cirrhose hépatique, de syndrome néphrotique, d'insuffisance surrénalienne
et d'hypothyroïdie.
Le traitement par desmopressine doit être interrompu dans les circonstances où il y a un déséquilibre au
niveau du bilan hydrique et/ou électrolytique (par exemple les infections systémiques, la fièvre, la gastro-
entérite).
Les patients atteints d'hypertension doivent être traités avec prudence et la pression artérielle doit être
contrôlée, bien qu'il soit peu probable que la desmopressine exerce un effet presseur à la posologie
prescrite.
Le diabète insipide peut parfois présenter un caractère transitoire (polyurie et syndrome polydipsique
après traumatisme ou interventions chirurgicales) et le traitement doit dès lors être étroitement surveillé.
Chez les patients atteints de mucoviscidose, l'administration de desmopressine doit être suivie de près.
4.5. Interactions avec d’autres médicaments et autres formes d’interactions
Les médicaments dont on sait qu'ils induisent un SIADH (syndrome de sécrétion inappropriée d'ADH),
tels qu'antidépresseurs tricycliques, chlorpropamide et oxcarbazépine, inhibiteurs sélectifs de la recapture
de la sérotonine, chlorpromazine et carbamazépine, peuvent avoir un effet antidiurétique et augmenter le
risque de rétention hydrique (voir 4.4).
On doit tenir compte du fait que dans ces cas, la posologie doit vraisemblablement être adaptée.
Les AINS peuvent provoquer une rétention hydrique/hyponatrémie (voir 4.4).
Un traitement simultané par lopéramide peut se traduire par une multiplication par 3 de la concentration
plasmatique de desmopressine, ce qui peut entraîner une augmentation du risque de rétention
hydrique/hyponatrémie.
Il est peu vraisemblable que la desmopressine présentera une interaction avec les médicaments qui
agissent sur le métabolisme hépatique, étant donné que des études in vitro portant sur des microsomes
humains ont démontré que la desmopressine ne subit pas de métabolisation significative au niveau du
foie. On n'a cependant pas encore réalisé d'étude formelle in vivo.
Un repas standardisé contenant 27% de graisse a significativement réduit l'absorption de la desmopressine
(degré et importance). On n'a pas observé d'effet significatif concernant la pharmacodynamie (production
d'urine ou osmolalité); par conséquent, la desmopressine peut être prise avec des aliments si on le
souhaite.
4.6. Fecondité, grossesse et allaitement
Grossesse
Les données relatives à un nombre limité de grossesses (n = 53) chez des femmes atteintes de diabète
insipide qui recevaient de la desmopressine, n'ont révélé aucun effet indésirable sur la grossesse ni sur la
santé du fœtus/nouveau-né. Jusqu'à présent, on ne dispose pas d'autres données épidémiologiques
pertinentes. Les études animales n'ont pas révélé d'effets néfastes directs ou indirects sur la grossesse, le
développement embryonnaire/fœtal, l'accouchement ou le développement postnatal. La prudence est de
rigueur lorsque le médicament est prescrit à des femmes enceintes.

Résumé des caractéristiques du produit
Lactation
Les résultats d'analyses de lait provenant de mères qui allaitaient et qui recevaient des doses élevées de
desmopressine (300 µg par voie intranasale), démontrent que les quantités de desmopressine qui seraient
transférées à l'enfant sont nettement plus faibles que les quantités nécessaires pour influencer la diurèse.
Desmopressine Ferring peut donc être utilisé sans inconvénient en cas d'allaitement.
4.7. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Desmopressine Ferring n’a aucune influence sur l’aptitude à conduire un véhicule ou à utiliser une
machine.
4.8. Effets indésirables
Un traitement sans réduction simultanée de la consommation de liquide peut entraîner une rétention d'eau
et/ou une hyponatrémie associées ou non à des signes d'alarme ou des symptômes (céphalées,
nausées/vomissements, prise de poids et, dans des cas graves, convulsions).
Une rétention d'eau peut se produire en cas de surdosage, de mauvaise indication ou de consommation
excessive de liquide pendant le traitement.
Enurésie nocturne et diabète insipide
Fréquent (≥1/100, <1/10)
Troubles généraux: céphalées
Affections gastro-intestinales: douleur abdominale, nausées.
Très rare (< 1/10.000)
Troubles du métabolisme et de la nutrition : hyponatrémie
On a mentionné quelques cas de démyélinisation dus à une correction trop rapide de la natrémie. Afin
d’éviter une correction excessive, il faut suivre étroitement une hyponatrémie sévère, selon les procédures
mentionnées dans la rubrique 4.9 (traitement en cas de surdosage).
Expérience post-commercialisation:
Troubles psychiques: on a rapporté des cas isolés de troubles émotionnels chez des enfants.
Affections du système immunitaire: on a, dans des cas isolés, rapporté des réactions allergiques générales
plus sévères telles qu'anaphylaxie et bronchospasme.
Nycturie
Pendant les essais cliniques, environ 35% des patients ont présenté des effets secondaires pendant la
titration de la dose. Les effets secondaires les plus fréquents pendant la titration de la dose ont été des
céphalées (15%), des nausées (5%), des douleurs abdominales (4%), une hyponatrémie (4%), des
étourdissements (3%) et une sécheresse buccale (3%). Pendant le traitement prolongé, 24% des patients
ont présenté des effets secondaires. Les effets secondaires les plus fréquents pendant le traitement à long
terme ont été des céphalées (6%), des étourdissements (3%), un œdème périphérique (3%), des mictions
fréquentes (2%), des nausées (2%) et un gain de poids (2%).
4.9. Surdosage
Un surdosage en Desmopressine Ferring entraîne une augmentation de la durée d'action avec une
rétention d'eau accrue et une hyponatrémie.
Traitement
Bien que le traitement de l'hyponatrémie doive être adapté individuellement, on peut émettre les
recommandations générales suivantes. L'hyponatrémie se traite en arrêtant le traitement par
desmopressine, en imposant une restriction hydrique et, si nécessaire, en administrant un traitement
symptomatique.
 6
6
 7
7
 8
8
1
/
8
100%