Bases pharmacologiques à l`utilisation des médicaments

Mini-revue
Bases pharmacologiques
à l’utilisation des médicaments hémostatiques
Agnès Lillo-Le Louët
1
, Dominique Lasne
2
, Chantal Rothschild
3
1
Centre Régional de pharmacovigilance, hôpital Européen Georges Pompidou, 20 rue Leblanc, 75015 Paris
2
Laboratoire d’Hématologie, hôpital Necker, 149 rue de Sèvres, 75015 Paris
3
Centre d’Hémophilie, hôpital Necker, 149 rue de Sèvres, 75015 Paris
De nombreux médicaments sont disponibles en France pour
traiter ou prévenir des manifestations hémorragiques survenant
en l’absence de toute anomalie caractérisée de l’hémostase ou
chez des patients porteurs d’une anomalie de l’hémostase,
qu’elle soit congénitale ou acquise. Cet article passe en revue
les principaux médicaments hémostatiques dont les modes
d’action, les modalités d’utilisation et les indications sont très
variés, ces dernières n’étant pas toujours validées par des
essais cliniques randomisés. Les antifibrinolytiques (acide tra-
néxamique et aprotinine) sont utilisés dans les situations hémor-
ragiques connues pour être habituellement associées à une
hyperfibrinolyse (métrorragies, chirurgie bucco-dentaire, chi-
rurgie cardiaque...). La desmopressine a des propriétés pro-
coagulantes car elle augmente la concentration plasmatique
des facteurs VIII et von Willebrand, d’où son utilisation dans
certains types de la maladie de Willebrand et dans l’hémophilie
A mineure. Elle est également utilisée chez l’insuffisant rénal et
le cirrhotique pour corriger les allongements inexpliqués du
temps de saignement. Les colles biologiques de par leur admi-
nistration locale sont utilisées en chirurgie et en endoscopie.
L’étamsylate est un produit synthétique dont le mécanisme
d’action n’est pas clairement élucidé et dont l’efficacité en tant
qu’agent hémostatique n’a pas clairement été démontrée. Un
traitement hormonal ou en l’absence de trouble de l’hémostase
un anti-inflammatoire non stéroïdien (principalement l’acide
méfénamique) sont classiquement proposés dans le traitement
des ménorragies. L’utilisation de certains de ces médicaments
n’est pas sans risque et doit faire l’objet d’une évaluation
rigoureuse du rapport bénéfice/risque pluridisciplinaire. Les
facteurs de la coagulation, qu’ils soient dérivés du sang ou
recombinants, ne seront pas abordés ici.
Mots clés :hémostase, hémostatiques, antifibrinolytique, colle
biologique, traitement hormonal
Tirés à part :
A. Lillo-Le Louët
Sang Thrombose Vaisseaux 2006 ;
18, n° 10 : 529-37
STV, vol. 18, n° 10, décembre 2006 529
doi: 10.1684/stv.2006.0040
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Les médicaments hémostatiques appartiennent à
plusieurs classes pharmacologiques. De nom-
breuses molécules sont commercialisées dans
des indications très diverses mais des essais cli-
niques ne sont disponibles que pour quelques-unes d’entre
elles, et pour certaines indications seulement. Dans les
résumés des caractéristiques du produit (RCP), certains
médicaments ne sont d’ailleurs que « proposés » et non pas
« indiqués » dans certaines situations. Leur mécanisme
d’action consiste soit à favoriser la coagulation (comme par
exemple la desmopressine et les colles biologiques), soit à
limiter la dégradation du caillot (comme les antifibrinolyti-
ques). D’autres molécules ont un mécanisme d’action
moins bien caractérisé comme l’étamsylate et les traite-
ments hormonaux. Cette revue n’aborde pas les facteurs de
la coagulation, qu’ils soient dérivés du sang ou recombi-
nants, utilisés pour compenser les déficits héréditaires ou
acquis en facteurs de coagulation. Elle n’abordera pas non
plus l’utilisation du facteur VII activé recombinant pour
rendre « supercoagulables » les patients à hémostase initia-
lement normale ou subnormale soumis à un risque hémor-
ragique majeur.
Place des agents hémostatiques
dans la prévention ou le contrôle
du saignement
Les agents hémostatiques sont utilisés afin de traiter ou de
prévenir des manifestations hémorragiques qui surviennent
en l’absence de toute anomalie caractérisée de l’hémostase.
Ils peuvent aussi être utilisés chez des patients porteurs
d’une anomalie de l’hémostase, congénitale ou acquise, en
complément éventuel du traitement substitutif spécifique.
Les antifibrinolytiques, la desmopressine, les traitements
hormonaux et les anti-inflammatoires non stéroïdiens (en
l’absence d’anomalie de l’hémostase) ont une place impor-
tante dans le traitement des méno-métrorragies. La desmo-
pressine est largement utilisée pour couvrir des gestes inva-
sifs comme une ponction biopsie chez un patient à risque
hémorragique non caractérisé (insuffisance rénale par
exemple).
Ces médicaments sont également utilisés dans certaines
chirurgies très hémorragiques, en complément de l’hémos-
tase chirurgicale afin de contrôler les pertes sanguines et de
limiter les transfusions. Les saignements en chirurgie sont
liés à la procédure chirurgicale ou à des facteurs non chirur-
gicaux multifactoriels, ce qui dans la plupart des cas ne
permet pas d’envisager un traitement spécifique. L’utilisa-
tion de médicaments tels que les antifibrinolytiques
concerne principalement la chirurgie cardiaque, la trans-
plantation hépatique et certaines procédures d’orthopédie.
Les colles biologiques sont utilisées dans de nombreuses
procédures chirurgicales ou endoscopiques, dans des situa-
tions à risque hémorragique ou simplement comme suture
d’appoint (« adhésif »).
La correction d’un déficit bien caractérisé en facteur de
l’hémostase peut se faire par substitution spécifique par des
médicaments dérivés du sang (MDS) ou des facteurs recom-
binants, surtout dans les déficits sévères. Cette substitution
spécifique n’est pas sans danger, notamment en raison des
risques infectieux potentiels des MDS ou du risque d’appa-
rition d’inhibiteurs. Les agents hémostatiques, principale-
ment la desmopressine et les antifibrinolytiques sont donc
également prescrits chez les patients ayant un déficit mo-
déré ou dans certaines circonstances dans les déficits sévè-
res en complément du traitement spécifique.
Les différents médicaments disponibles
en France (tableaux 1 et 2)
Les antifibrinolytiques
La fibrinolyse est un mécanisme physiologiquement impor-
tant dans le contrôle de l’hémostase. Elle correspond à la
solubilisation du thrombus fibrineux par la plasmine, sérine
protéase générée à partir du plasminogène. Le plasmino-
gène se lie aux résidus lysines à la surface de la fibrine et est
converti en plasmine par un activateur relargué des cellules
endothéliales : le t-PA (activateur tissulaire du plasmino-
gène). Des désordres de la fibrinolyse peuvent entraîner des
saignements sévères, qui peuvent être contrôlés par des
antifibrinolytiques. Par définition, les antifibrinolytiques
ne devraient être utilisés que dans les situations hémorragi-
ques où une hyperfibrinolyse est démontrée, afin de corri-
ger la balance hémostatique entre la coagulation et la fibri-
nolyse. En pratique, il n’existe pas de tests fiables pour
explorer la fibrinolyse en routine et guider la thérapeutique.
De fait, ils sont souvent utilisés de manière empirique dans
des situations connues pour générer une hyperfibrinolyse
comme dans les ménorragies [1], en chirurgie, principale-
ment chirurgie cardiaque avec circulation extracorporelle
mais aussi dans les transplantations hépatiques, certaines
chirurgies orthopédiques et urologiques [2]. Ces pratiques
pourraient évoluer si les bonnes performances des nouvel-
les générations de thromboélastographe pour détecter les
hyperfibrinolyses se confirment [3].
Il existe 2 classes d’antifibrinolytiques : les analogues de
lysine et les inhibiteurs de sérine protéase.
Les analogues de lysine
Les analogues de lysine lient de façon réversible les sites de
liaison lysine sur le plasminogène, ce qui empêche la fixa
STV, vol. 18, n° 10, décembre 2006
530
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

tion du plasminogène à la surface de la fibrine. Ainsi, même
si la plasmine est générée, elle ne peut agir sur la fibrine.
Parmi les analogues de lysine, seul l’acide tranéxamique
reste commercialisé en France (Exacyl
®
et Spotof
®
).
L’acide epsilon aminocaproïque n’est plus commercialisé
en France en raison du risque de rhabdomyolyse qui a
conduit à une abrogation de l’autorisation de mise sur le
marché de l’Hémocaprol
®
en 1995. Un collyre (Hexa-
lense
®
) contenant de l’acide aminocaproïque est commer-
cialisé comme traitement d’appoint de l’irritation conjonc-
tivale.
Les indications de l’acide tranéxamique concernent les
situations hémorragiques liées à une fibrinolyse généralisée
ou locale (méno-métrorragies, hémorragies digestives...)
ou en rapport avec un traitement fibrinolytique. Son effica-
cité dans les ménorragies s’explique par la mise en évi-
dence de taux élevés d’activateurs du plasminogène dans
l’endomètre des femmes ayant des saignements menstruels
plus importants que la moyenne [1]. Le traitement est pris
uniquement pendant la durée du saignement. La muqueuse
buccale et la salive étant toutes 2 riches en activateurs du
plasminogène, l’acide tranéxamique présente un intérêt
particulier en chirurgie buccodentaire en application locale
[4]. Il permet notamment de réaliser ce type de chirurgie
chez des patients sous anticoagulants oraux au long cours
avec maintien de la posologie ou simple réduction de poso-
logie. Il présente également un intérêt chez les hémophiles
pour réduire la consommation de facteur spécifique [5].
L’acide tranéxamique est aussi utilisé pour contrôler le
saignement et réduire les besoins transfusionnels dans
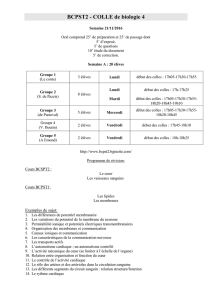
Tableau I.Caractéristiques des principaux médicaments hémostatiques ayant une autorisation
de mise sur le marché en France
DCI Nom commercial Voie(s)
d’administration
Indications retenues par l’autorisation
de mise sur le marché
Antifibrinolytiques
Inhibiteurs du
plasminogène
Acide tranéxamique
Exacyl
®
Voie orale et
intraveineuse Accidents hémorragiques dus une hyperfibrinolyse, qu’elle soit
primitive ou secondaire (méno-métrorragies, hémorragies
digestives, hématuries basses, hémorragies opératoires ORL)
Spotof
®
Gé Voie orale Idem Exacyl
®
Inhibiteurs de sérine
protéase Trasylol
®
Voie intraveineuse Syndromes hémorragiques fibrinolytiques et prévention des
risques hémorragiques fibrinolytiques en chirurgie cardiaque sous
circulation extra-corporelle, lorsqu’il existe un risque hémor-
ragique élevé
Aprotinine
Procoagulants
Desmopressine Minirin
®
Voie intraveineuse Prévention et traitement des accidents hémorragiques observés
dans l’hémophilie A (modérée et atténuée), la maladie de
Willebrand (en dehors des formes sévères ou de type 2b), en cas
d’allongement inexpliqué du temps de saignement en particulier
au cours de l’insuffisance rénale chronique. Complication des
traitements antiplaquettaires
Octim
®
Voie nasale Idem, à l’exception de l’utilisation chez l’insuffisant rénal
Hémostatiques locaux (produits dérivés du sang humain)
Colles biologiques Bériplast
®
Contient de l’aprotinine
Voie locale Usage local, traitement adjuvant dans toutes les disciplines
chirurgicales (y compris en endoscopie) pour l’hémostase
Tissucol
®
Contient de l’aprotinine
Voie locale Usage local, traitement adjuvant destiné à assurer l’hémostase lors
d’une intervention chirurgicale
Quixil
®
Contient de l’acide
tranéxamique
Voie locale Traitement d’appoint pour améliorer l’hémostase et réduire les
saignements au cours de la chirurgie hépatique (résection et
transplantation) et de la chirurgie orthopédique (remplacement
total de hanche et de genou)
Éponge Tachosil
®
Voie locale Traitement adjuvant en chirurgie pour améliorer l’hémostase
quand les techniques conventionnelles sont insuffisantes
Divers
Etamsylate Dicynone
®
Voie orale et
intraveineuse Traitement symptomatique des troubles fonctionnels de la fragilité
capillaire et traitement d’appoint des méno-métrorragies
AINS Ponstyl
®
Voie orale ou
suppositoire Ménorragies fonctionnelles restant inexpliquées après enquête
étiologique
Hémocoagulase Reptilase
®
Voie intraveineuse
et locale Traitement symptomatique des hémorragies chirurgicales,
médicales non liées à un déficit en facteurs de la coagulation et
(ou) à un allongement isolé du temps de saignement
STV, vol. 18, n° 10, décembre 2006 531
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

d’autres situations chirurgicales. Le plus grand nombre
d’études a été fait en chirurgie cardiaque [5-7]. Dans ces
études, une efficacité de l’acide tranéxamique sur la réduc-
tion des pertes sanguines [7], des transfusions [5] et de la
mortalité [6] est clairement démontrée. Dans d’autres chi-
rurgies à risque hémorragique comme la transplantation
hépatique et l’orthopédie, un bénéfice en termes de réduc-
tion des pertes sanguines postopératoires a également été
démontré [5].
L’acide tranéxamique est disponible sous la forme de
comprimé, de solution buvable ou de solution injectable.
La posologie habituelle chez l’adulte est de 2 à
4 g/24 heures, à répartir en 2 ou 3 administrations pour la
voie orale. Pour la voie parentérale, l’administration peut
se faire par injection intraveineuse lente ou en perfusion
continue. Chez l’enfant, la posologie est de 20 mg/kg/jour.
En chirurgie cardiaque, il n’existe pas de consensus sur la
dose optimale à utiliser. Divers protocoles sont proposés :
une dose de charge de 10 mg/kg suivie d’une perfusion de
1 mg/kg/heure
5
ou 50 à 100 mg/kg en perfusion de 5 à
10 minutes après l’induction [8]
.
Après injection intraveineuse, la demi-vie plasmatique est
voisine de 4 heures. L’élimination est essentiellement ré-
nale sous forme inchangée, ce qui nécessite une réduction
de posologie en cas d’insuffisance rénale avec une contre-
indication en cas d’insuffisance rénale grave.
Son administration est contre-indiquée en cas d’antécédent
de thrombose artérielle ou veineuse, de convulsions, et dans
les états fibrinolytiques réactionnels à une coagulopathie de
consommation. La survenue d’une hématurie est également
une contre-indication relative liée au risque d’anurie par
formation d’un caillot urétral. Les injections intrathécales,
intraventriculaires, les applications intracérébrales sont
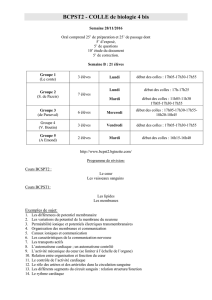
Tableau II.Indications validées des principaux hémostatiques
DCI nom
commercial
Indications validées
par des études cliniques
Modalités d’utilisation
particulières
Remarques
Acide tranéxamique
Exacyl
®
, Spotof
®
Méno-métrorragie →Voie orale, pendant la durée
du saignement Quelle que soit l’indication :
contre-indication en cas
d’insuffisance rénale grave, de
thrombose artérielle ou veineuse,
d’hématurie, de contact avec
les méninges
Chirurgie bucco-dentaire →En application locale, chez les
patients sous anti-coagulants
Réduction des pertes sanguines en
chirurgie cardiaque, orthopédique
et hépatique
Voie intraveineuse ou orale Diminuer la posologie en cas
d’insuffisance rénale modérée.
Aprotinine
Trasylol
®
Chirurgie cardiaque à haut risque
hémorragique
Autres chirurgies hémorragiques
Fibrinolyse
Voie intraveineuse exclusive
Attention à la posologie selon
le terrain et l’indication
Risque d’anaphylaxie : protocoles
avec prémédication et/ou dose test ;
savoir si il y a eu administration
antérieure d’aprotinine.
Risque potentiel de dysfonction
rénale et de thrombose en chirurgie
cardiaque : bien peser l’indication
Attention au risque anaphylactique
Desmopressine
Minirin
®
Octim
®
Maladie de Willebrand en dehors
des types 3 ou 2b
Forme atténuée d’hémophilie A
Conductrices d’hémophilie
à risque hémorragique
Voie intraveineuse (Minirin
®
)
Voie nasale (Octim
®
)Quelle que soit l’indication :
- réaliser préalablement un test
d’efficacité biologique
- diminuer la posologie chez
les patients âgés et/ou en cas
d’insuffisance coronarienne ou
d’hypertension
Acide méfénamique
Ponstyl
®
Méno-métrorragie Voie orale, pendant la durée
du saignement Intéressant en particulier en cas
de syndrome menstruel associé,
et/ou de migraine.
Traitement hormonal
Dispositif intra-utérin Méno-métrorragie Intéressant si contraception
souhaitée
Colles biologiques ou
éponge
Traitement adjuvant pour
l’hémostase en chirurgie hépatique Attention au risque anaphylactique
pour les colles contenant
de l’aprotinine.
Pas de contact avec les méninges
pour les colles contenant de l’acide
tranéxamique.
Il s’agit de médicaments dérivés
du sang humain.
STV, vol. 18, n° 10, décembre 2006
532
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

également contre-indiquées en raison du risque d’œdème
cérébral et de convulsion.
L’acide tranéxamique est habituellement bien toléré ; les
effets indésirables rapportés sont des troubles digestifs
bénins (nausées, vomissements, diarrhée), une hypotension
survenant particulièrement en cas d’injection intraveineuse
rapide et des troubles de la vision des couleurs. L’acide
tranéxamique entre également dans la composition de cer-
taines colles biologiques (Quixil
®
, voir détail ci-dessous).
Les inhibiteurs de sérines protéases
L’inhibiteur de sérine protéase le plus étudié et utilisé en
tant qu’agent antifibrinolytique est l’aprotinine, polypep-
tide extrait du poumon de bœuf. L’aprotinine inhibe diver-
ses sérines protéases dans le plasma comme la trypsine, la
kallikréine, la plasmine et l’élastase par formation de com-
plexes réversibles. Son activité est exprimée en unités inhi-
bitrices de kallikréine (UIK). Les doses utilisées semblent
déterminer le mécanisme d’action de l’aprotinine. De fai-
bles concentrations plasmatiques (de l’ordre de 50 UIK/ml)
permettraient l’inhibition de la plasmine, alors que de fortes
concentrations (de l’ordre de 200 UIK/ml) seraient néces-
saires pour inhiber la kallikréine et permettre à l’aprotinine
d’avoir un effet anti-inflammatoire [9].
L’aprotinine est commercialisée en France sous le nom de
Trasylol
®
disponible uniquement par voie intraveineuse.
Elle est indiquée dans le traitement des syndromes hémor-
ragiques fibrinolytiques et en prévention en chirurgie
cardiaque avec circulation extracorporelle et risque hémor-
ragique élevé (réintervention, traitement par anti-
plaquettaires). L’aprotinine entre dans la composition de
certaines colles biologiques administrées par voie topique
ou par infiltration (Beriplast
®
, Tissucol
®
, voir détail ci-
dessous). L’utilisation de l’aprotinine en chirurgie cardia-
que repose sur de nombreuses études cliniques. Une méta-
analyse a confirmé son efficacité par la réduction des pertes
sanguines et des transfusions, ainsi que par la réduction du
nombre de reprises chirurgicales et du taux de mortalité [6].
Le bénéfice sur les reprises chirurgicales et la mortalité
serait plus important lorsque des doses élevées d’aprotinine
sont utilisées. Son efficacité à fortes doses est également
démontrée en pédiatrie [10]. Le bénéfice observé dans les
chirurgies cardiaques à haut risque hémorragique serait lié
à l’action antifibrinolytique mais aussi à une préservation
des fonctions plaquettaires et à un effet anti-inflammatoire
[2]. L’aprotinine est également utilisée dans d’autres chi-
rurgies hémorragiques comme la transplantation hépatique
et certaines chirurgies orthopédiques afin de limiter les
besoins transfusionnels et les complications hémorragiques
[11, 12].
La posologie recommandée dans la fibrinolyse aiguë est de
500 000 à 1 million d’UIK en injection IV lente, sans
dépasser 5 mL/minute. En chirurgie cardiaque, les doses
conventionnelles recommandées sont les fortes doses soit
une dose de charge de 2 millions UIK suivie d’une perfu-
sion continue de 500 000 UIK/heure et 2 millions d’UIK
dans le liquide de remplissage de la pompe. De plus faibles
doses peuvent être administrées chez des patients à moindre
risque hémorragique. L’aprotinine doit être administrée par
une voie veineuse propre car en solution elle est physique-
ment incompatible avec des molécules fréquemment utili-
sées en anesthésie-réanimation, en particulier avec l’hépa-
rine, les corticoïdes, les tétracyclines, les émulsions
lipidiques et les acides aminés.
L’aprotinine est éliminée suivant un modèle biphasique
avec une phase rapide de 40 minutes suivie d’une phase
plus lente d’environ 7 heures. Sa demi-vie est de 2 heures.
Bien qu’éliminée par voie rénale, une adaptation posologi-
que n’est pas nécessaire en cas d’insuffisance rénale, car
elle est éliminée sous forme inactive. Cependant, récem-
ment, 2 études suggèrent que l’utilisation de l’aprotinine en
chirurgie cardiaque serait associée à un effet délétère sur la
fonction rénale [7, 8]. L’étude observationnelle de Man-
gano et al incluant 4 374 patients recevant de l’acide tra-
néxamique, de l’acide epsilon aminocaproïque, de l’aproti-
nine ou aucun antifibrinolytique rapporte une altération de
la fonction rénale et une augmentation du risque d’insuffi-
sance rénale dans le groupe aprotinine. Il s’agirait d’un
risque dose-dépendant puisque les atteintes rénales sont
plus fréquentes chez les patients recevant les fortes doses
d’aprotinine. Dans une autre étude incluant 10 870 patients
recevant de l’acide tranéxamique ou de l’aprotinine à fortes
doses, l’association entre l’aprotinine et la survenue d’une
insuffisance rénale est davantage prononcée chez les pa-
tients présentant une atteinte rénale préexistante [8].
L’étude de Mangano et al. conclut également à une aug-
mentation importante du risque d’infarctus du myocarde,
d’insuffisance cardiaque, d’accident vasculaire cérébral et
d’encéphalopathie dans le groupe de patients recevant
l’aprotinine par comparaison aux 3 autres groupes (acide
tranéxamique, acide epsilon aminocaproïque ou aucun anti-
fibrinolytique). Bien que critiquable sur le plan méthodolo-
gique [13], cette étude souligne la nécessité de réévaluer le
rapport bénéfice/risque de l’aprotinine particulièrement en
chirurgie cardiaque où d’autres alternatives efficaces en
termes d’épargne sanguine et moins coûteuses existent,
comme l’acide tranéxamique [8].
L’aprotinine est un polypeptide hétérologue d’origine bo-
vine pouvant entraîner des réactions d’hypersensibilité es-
sentiellement après expositions répétées [14]. Le risque
chez des patents « réexposés » est approximativement de
STV, vol. 18, n° 10, décembre 2006 533
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%