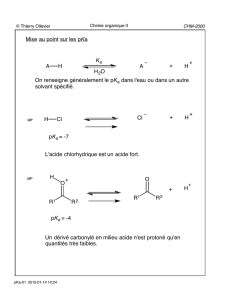
Acides carboxyliques et dérivés

© Thierry Ollevier CHM-2000
Chimie organique II
ACIDES CARBOXYLIQUES ET DÉRIVÉS
Introduction
RCOH
O
RCCl
O
RCO
OO
R' RCOR'
O
RCNH
O
H
RCNR'
O
H
RCNR'
O
R"
Acides carboxyliques
Chlorures d'acides Anhydrides d'acides Esters
Amides
R C N
Nitriles
R = C sp3, sp2 ou sp
derivesacides-01 2016-01-12 18:39

© Thierry Ollevier CHM-2000
Chimie organique II
Nomenclature des acides carboxyliques
HOH
O
CH3CH2OH
O
CH3OH
O
CH3(CH2)2OH
O
acide méthanoïque
acide éthanoïque
acide propanoïque
acide butanoïque
nom systématique nom courant
acide formique
acide acétique
acide propionique
acide butyrique
CH3
H Br
O
OH acide (R)-2-bromopropanoïque
O
OH
H
H
H
acide propénoïque
derivesacides-02 2016-01-12 18:43

© Thierry Ollevier CHM-2000
Chimie organique II
Nomenclature des acides carboxyliques (suite)
OH
O
HO
O
acide éthanedioïque acide oxalique
acide glutarique
NH2
CH3acide 2-aminopropanoïque
nom systématique nom courant
alanine
O
HO
O
OH
O
OH
OH
O
NH2
Racides α-aminés
OH
O
acide benzoïque
derivesacides-03 2016-01-12 19:14

© Thierry Ollevier CHM-2000
Chimie organique II
C
O
H
O
ou C
OH
O
CO2HCOOH
ou
ou
= groupe carboxyle ou carboxylique
R
C
O
H
O
basique
basique
R
C
O
H
O
acide
électrophile
(δ+)
R
C
O
H
O
120°
120°
120°
R
C
O
H
O
106°
H
C
O
H
O
l'acide formique est une molécule plane !
sp2
Structure
derivesacides-04 2016-01-12 18:42

© Thierry Ollevier CHM-2000
Chimie organique II
Acidité des acides carboxyliques
RCOOH H2OH3O
++
Plus R sera capable de stabiliser une charge négative,
plus l'acide sera acide (Ka grand et pKa petit).
Kéq.
Kéq. =[RCOO-] [H3O+]
[RCOOH] [H2O]
Ka = Kéq. [H2O].
pKa = -log Ka
Les acides carboxyliques ont souvent des valeurs de pKa
comprises entre 4 et 5.
RCOO
CH3OH
O
pKa = 4,75
Dans le cas de groupes R particulièrement capables de stabiliser
la charge négative dans l'ion carboxylate, les valeurs de pKa
pourront être inférieures à 4-5.
ex.
derivesacides-05 2016-01-12 18:42
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%