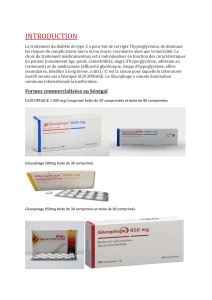
Acidose lactique sévère par intoxication accidentelle à la metformine

Journal Identification = ABC Article Identification = 0619 Date: November 9, 2011 Time: 12:22 pm
doi:10.1684/abc.2011.0619
705
Pour citer cet article : Roche C, Nau A, Peytel É, Moalic JL, Oliver M. Acidose lactique sévère par intoxication accidentelle à la metformine : à propos de 3 observations.
Ann Biol Clin 2011 ; 69(6) : 705-11 doi:10.1684/abc.2011.0619
Biologie au quotidien
Ann Biol Clin 2011 ; 69 (6) : 705-11
Acidose lactique sévère par intoxication accidentelle
à la metformine:àpropos de 3 observations
Severe lactic acidosis due to metformin: report of 3 cases
Céline Roche1
André Nau2
Éric Peytel2
Jean-Luc Moalic1
Manuela Oliver1
1Fédération des laboratoires
2Service de réanimation (Pr Peytel),
hôpital d’instruction des armées
Laveran, Marseille, France
Article rec¸u le 17 février 2011,
accept´
e le 7 avril 2011
Résumé. La metformine, antidiabétique oral, est l’unique représentant de la
classe des biguanides commercialisé en France. En raison de ses effets béné-
fiques sur le poids et au niveau cardiovasculaire, il représente le traitement
de référence du diabétique de type 2 obèse. L’acidose lactique associée à la
metformine est une complication rare mais grave qui peut survenir chez ces
patients, notamment lorsqu’un épisode intercurrent favorise l’accumulation de
cette molécule. Nous rapportons trois observations dont l’origine toxique de
l’acidose a été objectivée par les dosages plasmatiques et intra-érythrocytaires
de metformine. Le traitement curatif repose sur l’épuration extrarénale mais le
traitement principal est préventif, imposant le respect des contre-indications et
des règles de bonne prescription de ce médicament.
Mots clés : acidose lactique, metformine, biguanides, diabète, intoxication
Abstract. Metformin, an oral antidiabetic drug, is the sole representative of the
biguanide class available in France. Because of its beneficial effects on weight
and cardiovascular level, it represents the standard treatment for type 2 diabetic
obese patients. Lactic acidosis associated with metformin is a rare but serious
complication that can occur in these patients, particularly when intercurrent
episode promotes the accumulation of this molecule. We report three cases in
which the toxic origin of acidosis has been objectified by the plasma assay and
intra-erythrocyte metformin. Curative treatment is based on renal replacement
therapy, but the main treatment is preventive, requiring compliance with the
cons-indications and rules of prescription of this drug.
Key words: lactic acidosis, metformin, biguanides, diabetes, poisoning
Le diabète de type 2 est un problème de santé publique,
touchant près de trois millions de franc¸ais actuellement et
dont l’incidence ne cesse d’augmenter ces dernières années
[1]. Les décompensations hyperglycémiques (acidocétose
diabétique, syndrome d’hyperglycémie hyperosmolaire)
et l’hypoglycémie sont des complications assez fré-
quentes, source d’un grand nombre d’admissions en service
d’urgence et de réanimation. L’incidence de l’acidose lac-
tique est plus faible, comprise entre deux et neuf pour
100 000 patients par an [2] mais s’avère plus grave. Cette
complication peut survenir lors d’intoxications acciden-
telles ou volontaires à la metformine. Le surdosage est alors
favorisé par l’insuffisance rénale et le pronostic se trouve
être radicalement différent selon la situation clinique. Les
observations suivantes illustrent cette hétérogénéité et sont
l’occasion de rappeler les mécanismes de toxicité de ce
médicament.
L’observation 1
Monsieur G., 53 ans, est admis au service des urgences
de notre hôpital en raison d’épisodes de vomissements
itératifs depuis la veille, compliqués d’une somnolence.
Ce patient présente comme antécédents une insuffisance
coronarienne, un diabète de type 2 traité par metformine,
une dyslipidémie et un syndrome dépressif. Il se plaint
depuis 48 heures d’asthénie, d’anorexie, de nausées et de
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0619 Date: November 9, 2011 Time: 12:22 pm
706 Ann Biol Clin, vol. 69, n◦6, novembre-décembre 2011
Biologie au quotidien
vomissements. Peu après son admission aux urgences,
il présente des troubles de la vigilance ainsi que des
signes d’hypoperfusion périphérique (marbrures étendues
aux deux membres inférieurs), sans altération de l’état
hémodynamique (pression artérielle = 157/95 mmHg). La
protidémie est de 91 g/L (N : 63-81 g/L) et l’urémie de
22,2 mmol/L (N : 3,2-8,3 mmol/L), confirmant une situa-
tion de déshydratation extracellulaire avec insuffisance
rénale fonctionnelle. La gazométrie artérielle retrouve une
acidose métabolique majeure : pH égal à 6,78 ; PaCO2
inférieur à 10 mmHg ; lactates égaux à 13 mmol/L (N :
0,5-2,2 mmol/L), CO2total égal à 2 mmol/L (N : 23-
25 mmol/L). Le patient est alors transféré en service de
réanimation. Outre une hypothermie à 34,5 ◦C, une tachy-
cardie régulière et une polypnée, il présente des signes
de défaillance neurologique avec un score de Glasgow à
12, une mydriase bilatérale réactive et une obnubilation.
L’examen physique retrouve seulement une sensibilité au
niveau de l’hypochondre droit. Le bilan biologique montre
une hyperglycémie à 110 mmol/L (N : 4,20-5,80 mmol/L),
une hyperkaliémie à 7,3 mmol/L, une insuffisance rénale
avec clairance de la créatinine mesurée à 9 mL/min (valeurs
usuelles : 80 à 120 mL/min), un syndrome inflammatoire
biologique (CRP = 24 mg/L) et des stigmates de pancréa-
tite aiguë : lipasémie à 185 UI/L (N : 13-60 UI/L). Le bilan
toxicologique initial comprenant la recherche d’alcool, de
salicylés, benzodiazépines, phénobarbital et tricycliques,
est négatif, de même que la recherche de corps céto-
niques. La polypnée majeure du patient impose la mise
sous ventilation mécanique. Devant ce tableau clinique
associant état de choc, acidose métabolique majeure et
insuffisance rénale aiguë, un traitement symptomatique
comprenant un remplissage vasculaire avec amines vaso-
pressives et une épuration extrarénale par hémodialyse
conventionnelle est instauré. Dans l’hypothèse d’une sur-
infection pulmonaire, une antibiothérapie probabiliste est
prescrite.
Le lendemain, le patient présente des signes de souf-
france myocardique (augmentation de la troponine Ic sans
manifestation électrocardiographique) avec altération de
la fonction ventriculaire gauche. L’état acidobasique et
les troubles ioniques s’améliorent dès les 48 premières
heures, mais l’insuffisance rénale persiste et le syndrome
inflammatoire biologique s’intensifie. À j3, le sevrage de
la noradrénaline est possible, mais le patient requiert une
assistance respiratoire jusqu’au septième jour et développe
une pneumopathie bilatérale.
À j6 est diagnostiqué un surdosage en metformine sur un
prélèvement réalisé lors de l’admission en réanimation. La
metformine plasmatique est mesurée à 31,3 mg/L (valeurs
thérapeutiques inférieures à 1,34 mg/L) et la metformine
érythrocytaire à 22,3 mg/L (valeurs thérapeutiques infé-
rieures à 1,65 mg/L). L’insuffisance rénale persiste durant
le séjour en réanimation et des séances d’hémodialyse sont
nécessaires jusqu’au dixième jour.
Au cours de son hospitalisation, le patient présente une
agitation psychomotrice importante associée à une déso-
rientation temporelle et de nombreuses hallucinations, en
rapport avec un probable sevrage brutal en benzodiazépines.
Le patient nie toute intention suicidaire.
L’intoxication à la metformine sera considérée comme acci-
dentelle, favorisée par l’insuffisance rénale générée par une
probable déshydratation dans un contexte de préparation
colique la semaine précédente sans apport compensateur
en boissons.
L’observation 2
Monsieur K., âgé de 65 ans est hypertendu et diabé-
tique, traité par metformine, acarbose et gliclazide. Il
présente un syndrome grippal accompagné de vomis-
sements incoercibles, diarrhées et de difficultés pour
s’alimenter depuis quatre jours. L’apparition de troubles
de la conscience et d’une désorientation temporospa-
tiale motivent son transfert médicalisé vers le service des
urgences. À l’arrivée, le patient est polypnéique (fréquence
respiratoire : 32/min). Il présente une acidose lactique (lac-
tates : 10,6 mmol/L) majeure (pH : 6,81) avec hypocapnie
compensatrice (pCO2: 15 mmHg), associée à une hyper-
kaliémie à 7,1 mmol/L et une insuffisance rénale aiguë
(clairance de la créatinine mesurée : 4 mL/min). Le patient
nécessitant une intubation orotrachéale et une épuration
extrarénale en urgence, il est alors transféré en réanimation.
Il bénéficie également d’un remplissage vasculaire, d’un
soutien hémodynamique par noradrénaline, d’un traitement
hypokaliémiant et d’une antibiothérapie probabiliste.
À j3, apparaît une souffrance myocardique (troponine à
9g/L pour des valeurs usuelles inférieures à 0,01 g/L).
Le patient reprend une ventilation spontanée dès le
lendemain.
À j7, une amélioration sur le plan hémodynamique permet
un sevrage des amines vasopressives et à j10, le patient ne
requiert plus d’épuration extrarénale. Il est alors transféré
en service de cardiologie.
Les concentrations plasmatiques et érythrocytaires sont
respectivement mesurées à 113 et 61 mg/L, confirmant
une intoxication accidentelle à ce médicament, potentia-
lisée par une déshydratation : protidémie à 88 g/L (N :
63-81 g/L), urémie à 62,2 mmol/L (N : 3,2-8,3 mmol/L).
L’interrogatoire retrouvera la notion d’un épisode diar-
rhéique aigu à l’origine de cette déshydratation.
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0619 Date: November 9, 2011 Time: 12:22 pm
Ann Biol Clin, vol. 69, n◦6, novembre-décembre 2011 707
Acidose lactique à la metformine
L’observation 3
Madame R., 80 ans, est diabétique traitée par metfor-
mine, hypertendue et dépressive. Dans les suites d’une
pyélonéphrite récidivante, elle présente un épisode de dys-
pnée avec polypnée motivant son admission au service des
urgences. À son admission, la patiente présente des mar-
brures, une hypotension artérielle réfractaire au remplissage
vasculaire, nécessitant donc la mise en place d’amines
vasopressives. Son état se dégrade avec une majoration
de la dyspnée et l’apparition de troubles neurologiques
(score de Glasgow à 6). Elle est alors admise en réanima-
tion pour choc septique sur pyélonéphrite et pneumopathie
lobaire supérieure droite, compliquée d’une acidose lac-
tique (lactates = 8,0 mmol/L) majeure (pH = 7,00) et d’une
hyperkaliémie à 5,4 mmol/L. Elle bénéficie d’un traitement
de soutien hémodynamique (remplissage vasculaire et nora-
drénaline), d’une antibiothérapie et d’une hémodiafiltration
veinoveineuse continue dès le lendemain pour altération
de sa fonction rénale (clairance mesurée de la créatinine :
35 mL/min). Initialement, la patiente présentait un état de
déshydratation extracellulaire avec une insuffisance rénale
fonctionnelle débutante (urée : 110 mmol/L). Dès le troi-
sième jour, la situation hémodynamique se stabilise et la
patiente reprend une diurèse avec amélioration rapide de
la fonction rénale. L’évolution clinique est marquée par
l’apparition de rectorragies révélatrices d’une colite isché-
mique secondaire au choc septique.
Sur le plan biologique, le syndrome inflammatoire régresse
et les dosages de metformine (sur un prélèvement anté-
rieur à l’épuration extrarénale) indiquent une concentration
plasmatique de 7 mg/L (N : 1-1,34 mg/L) et érythrocy-
taire à 5,4 mg/L (N : 0-1,65 mg/L), confirmant une acidose
lactique associée à la metformine chez cette patiente. Le fac-
teur favorisant retrouvé est très probablement la survenue
d’une pyélonéphrite compliquée d’un choc septique.
Discussion
La metformine : antidiabétique efficace
nécessitant une attention particulière
Unique représentant de la classe des biguanides en France,
la metformine représente un traitement efficace du diabète
de type 2 non insulinorequérant, avec un contrôle glycé-
mique équivalent à celui de l’insuline et des sulfamides
hypoglycémiants [3].
Ses bénéfices sont multiples, à la fois sur les complications
microvasculaires et macrovasculaires. Ses effets bénéfiques
sur le poids (par diminution de l’insulinémie), sur le bilan
lipidique, son effet protecteur chez l’insuffisant cardiaque
[4] et après chirurgie cardiaque en font le traitement de
référence chez le diabétique obèse [5].
Cependant, la metformine est réputée augmenter
l’incidence des acidoses lactiques [6] à l’instar des
autres biguanides retirés du marché (phenformine). À
partir de ces trois observations cliniques et après un
rappel sur les propriétés des biguanides, nous discuterons
des différents aspects de l’acidose lactique associée à la
metformine.
Pharmacocinétique
Après ingestion, la diméthylbiguanide ou metformine est
absorbée au niveau de l’intestin grêle. Dans le plasma, il se
comporte comme une molécule hydrophile complètement
ionisée et ses concentrations maximales sont atteintes en
une à deux heures avec des valeurs de1à3mg/L après une
prise de 500 à 1 000 mg. Les concentrations érythrocytaires
sont égales à deux tiers des concentrations plasmatiques. La
metformine a une demi-vie plasmatique comprise entre 4
et 8,7 heures. Non liée aux protéines plasmatiques et non
métabolisée, elle est éliminée majoritairement (90 %) par
voie rénale.
Mécanismes d’action
La metformine agit à la fois sur le métabolisme glucidique
et lipidique. Ses effets métaboliques sont résumés dans le
tableau 1. Le contrôle glycémique tient davantage à une
action anti-hyperglycémiante plutôt qu’hypoglycémiante.
Le contrôle lipidique se traduit par une baisse du cholestérol
total, du LDL-cholestérol et des triglycérides sériques.
La metformine agit également sur la coagulation en
diminuant l’agrégation et l’adhésion plaquettaire, et en
augmentant la fibrinolyse et l’activité tissulaire du plasmi-
nogène.
Tableau 1. Effets métaboliques de la metformine.
Effets sur le métabolisme glucidique
Réduction de l’insulinorésistance
Amélioration de la sensibilité à l’insuline au niveau hépatique et
périphérique par augmentation du transfert du glucose vers la
membrane cellulaire, de l’activité des transporteurs du glucose
GLUT 4 et GLUT 1 et par une action sur la signalisation après
stimulation des récepteurs tyrosine-kinase insuliniques
Diminution de la production hépatique de glucose : inhibition de
la néoglucogenèse à partir de différents substrats (lactates,
pyruvates, acides aminés) et augmentation de la glycogénolyse
Augmentation de l’utilisation périphérique du glucose :
augmentation de la captation du glucose par le muscle
squelettique, oxydation et stockage au niveau du muscle
et des adipocytes
Ralentissement de l’absorption intestinale de glucose et
élévation de son utilisation à ce niveau (diminuant l’afflux portal)
Effets sur le métabolisme lipidique
Diminution de l’oxydation des lipides
Diminution de la concentration des acides gras libres
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0619 Date: November 9, 2011 Time: 12:22 pm
708 Ann Biol Clin, vol. 69, n◦6, novembre-décembre 2011
Biologie au quotidien
Acidose lactique associée à la metformine :
une complication rare mais grave
Épidémiologie
L’acidose lactique liée à la metformine est plus rare [7] que
les autres complications aiguës du diabète de type 2 que
sont les décompensations hyperglycémiques (acidocétose
diabétique, syndrome d’hyperglycémie hyperosmolaire) et
l’hypoglycémie. Son incidence est de deux à neuf pour
100 000 patients par an en France, soit dix à 20 fois moins
que celle de la phenformine, aujourd’hui retirée du marché.
En revanche, elle représente la complication la plus grave
dans la mesure où elle est grevée d’une mortalité très impor-
tante [8]. L’âge moyen de survenue de cette complication
est de 69 ans.
Physiopathologie
Le mécanisme impliqué dans l’hyperlactatémie associée
au traitement par biguanide est complexe et multifactoriel.
L’accumulation de lactates résulte à la fois d’une baisse de
son utilisation et d’une augmentation de sa production, en
favorisant :
– la diminution de la néoglucogenèse à partir de différents
substrats dont le lactate, via l’inhibition du complexe 1 de
la chaîne respiratoire mitochondriale [9] ;
– l’augmentation du ratio NAD/NADH+ avec élévation du
flux au travers de la pyruvate kinase [10], telle que décrite
sur la figure 1 ;
– l’augmentation de la production intestinale de lactate.
Ce déséquilibre entre la production et l’utilisation de lac-
tates surviendrait à l’occasion d’un surdosage (secondaire
au non-respect des contre-indications dans la plupart des
cas) ou d’une défaillance d’organe.
Chez un patient diabétique traité par biguanides, trois prin-
cipales situations cliniques peuvent expliquer la survenue
d’une acidose lactique. Les observations rapportées illus-
trent cette hétérogénéité. L’acidose lactique de type A peut
révéler une cause sous-jacente telle qu’un état de choc, une
insuffisance hépatocellulaire [11], une détresse respiratoire
ou hémodynamique et de fac¸on plus générale toute situation
engendrant une hypoxie tissulaire. Dans cette situation, la
présence de metformine n’est qu’anecdotique. Son dosage
rapporte fréquemment des concentrations thérapeutiques.
Dans l’acidose lactique de type B, situation de pronostic
plus favorable que la précédente [12], la metformine est
la cause de l’acidose lactique du fait d’un surdosage acci-
dentel ou volontaire. L’acidose survient à l’occasion de
facteurs favorisant l’accumulation plasmatique de metfor-
mine, en particulier la présence d’une insuffisance rénale
[13], la metformine étant exclusivement éliminée par voie
urinaire. Concernant nos patients, l’acidose lactique est sur-
venue vraisemblablement à l’occasion d’une insuffisance
rénale fonctionnelle par déshydratation due à un défaut
d’hydratation compensatrice, dans un contexte de prépa-
ration colique pour le premier patient et de gastro-entérite
pour le second.
L’observation no3 illustre une autre situation plus fréquem-
ment retrouvée où une cause extérieure est responsable de
l’acidose lactique [14]. Chez notre patiente, l’acidose lac-
tique est initialement imputable au choc septique et a été
aggravée par l’accumulation de metformine. Le pronostic
du tableau clinique est alors surtout lié à celui de la cause
GIucose
GIucose 6-phosphate
GIycogène
Membrane
plasmique
Membrane
mitochondriale
ADP
ADP
ADP
AT P
AT P
AT P
NAD
NADH
NADH + O2
H+H+
NAD + H2O
CO2
Alanine
Acidose
Alcalose
LactatePyruvate Lactate
Figure 1. Potentiel d’oxydoréduction et régulation de la glycolyse (Jaouar et al., Médecine thérapeutique).
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0619 Date: November 9, 2011 Time: 12:22 pm
Ann Biol Clin, vol. 69, n◦6, novembre-décembre 2011 709
Acidose lactique à la metformine
initiale. Dans notre observation, l’amélioration rapide du
choc septique a permis l’évolution favorable de la patiente.
Parmi les trois patients, deux étaient suivis pour des
troubles dépressifs. C’est l’occasion de souligner que chez
ces patients souffrant d’une maladie chronique comme
le diabète, il est important de pousser l’interrogatoire à
la recherche de troubles psychiques débutants, afin de
ne pas méconnaître une intoxication volontaire par la
metformine.
Tableau clinico-biologique
L’acidose lactique associée à la metformine ne présente
pas de particularité sur le plan clinique. Les principaux
symptômes associés sont d’ordre digestif (malaise, dou-
leurs abdominales, anorexie), respiratoire (polypnée), ou
hémodynamique (hypotension par vasoplégie, troubles du
rythme cardiaque). Des signes cliniques moins spécifiques
sont également retrouvés tels qu’une hypothermie ou des
myalgies. Nos deux premiers patients présentaient une
symptomatologie digestive (vomissements, anorexie voire
diarrhée) compliquée secondairement par une dégradation
hémodynamique. La troisième patiente quant à elle présen-
tait d’emblée une détresse hémodynamique secondaire à un
choc septique.
L’acidose lactique est définie par un pH inférieur à 7,35
et une concentration en lactate supérieure à 5 mmol/L.
Elle est souvent accompagnée d’une insuffisance rénale
aiguë hyperkaliémique. Le diagnostic d’acidose lactique
associée à la metformine est confirmé par les dosages
de metformine plasmatique et/ou érythrocytaire dont les
concentrations thérapeutiques sont habituellement infé-
rieures à 1,34 et 1,65 mg/L respectivement. L’accumulation
est définie par une concentration de metformine plasma-
tique supérieure à 5 mg/L. Alors que les concentrations
plasmatiques sont associées à un phénomène aigu, les
concentrations érythrocytaires sont le reflet du caractère
profond d’une accumulation tissulaire. Ainsi, le dosage
intra-érythrocytaire semble intéressant dans la mesure où
il permet d’établir le diagnostic de surdosage chronique.
Dans les deux premières observations, les taux de metfor-
mine érythrocytaires supérieurs à 20 mg/L laissent supposer
un surdosage d’installation progressive.
D’un point de vue pratique, ce dosage est du ressort de labo-
ratoires très spécialisés et n’est pas réalisé en urgence. Les
résultats étant disponibles seulement après plusieurs jours,
le diagnostic de surdosage est donc toujours confirmé a pos-
teriori. Le surdosage peut également être sous-diagnostiqué
[15] du fait d’un défaut ou d’un retard à la prescription de
ces dosages par le médecin en charge du patient. Dans notre
cas, le dosage a pu être effectué sur un prélèvement réalisé
à l’entrée du patient car les prélèvements sont conservés au
laboratoire sept joursà+4◦C. Les résultats ont été obtenus
en moyenne au bout d’une semaine.
Si le surdosage en metformine engendre une acidose lac-
tique [16], il semble ne pas exister de lien entre les
concentrations de metformine ou de lactates et la mor-
talité [2, 17]. En particulier, certains auteurs rapportent
que l’instauration d’un traitement par metformine ne
s’accompagne pas d’une augmentation significative de la
lactatémie ni de l’incidence des acidoses lactiques [18].
De plus, des intoxications aiguës à la metformine sont
retrouvées sans acidose lactique associée [19]. A contrario,
comme nous l’avons déjà souligné, d’authentiques acidoses
lactiques peuvent survenir alors que les dosages de metfor-
mine rapportent des valeurs thérapeutiques [20].
D’autres études rapportent une moindre mortalité chez
les patients ayant les plus forts taux de metformine plas-
matique, le rôle bénéfique de la metformine dans les
acidoses lactiques pouvant s’expliquer par ses propriétés
anti-oxydantes.
Le pronostic semble donc déterminé non pas par la sévé-
rité de l’acidose ni par la concentration de metformine
(plasmatique ou érythrocytaire) mais par les pathologies
sous-jacentes [21, 22] de ces patients : insuffisance hépa-
tique, rénale, coronaire, facteurs de risque cardiovasculaire.
Il peut s’agir d’un épisode intercurrent précipitant l’acidose
lactique ou la survenue de facteurs favorisants conduisant
à l’accumulation plasmatique de metformine [23].
Prise en charge thérapeutique
La correction de l’acidose et de la lactatémie ne sont
pas systématiques dans la mesure où les études cliniques
n’ont pas prouvé son efficacité. Certaines mettent en
avant le rôle protecteur de l’acidose [24]. En revanche,
l’utilisation d’un tampon bicarbonate se justifie lorsque
l’acidose est très sévère (pH <7) ou se prolonge dans le
temps. La metformine étant dialysable, le traitement cura-
tif de première ligne de l’acidose lactique associée à la
metformine est l’épuration extrarénale [25] (hémodialyse
ou hémodiafiltration). Cette technique permet par la même
occasion de suppléer l’insuffisance rénale et de corriger
l’hyperlactatémie. Parmi les différentes techniques de dia-
lyse disponibles, l’épuration continue est privilégiée [26]
dans la mesure où elle engendre un moindre retentisse-
ment hémodynamique. Cette technique a été retenue pour
nos patients. Alors que l’épuration s’est prolongée sur une
dizaine de jours pour les deux premiers patients, une seule
séance a été nécessaire pour le troisième. Cette hétérogé-
néité dans le pronostic est liée à celle des situations cliniques
à l’origine de l’acidose lactique (déshydratation vs sepsis
sévère).
Le traitement des défaillances d’organes associées (respira-
toire, cardio-circulatoire...) est primordial : il repose sur
des mesures purement symptomatiques (assistance venti-
latoire, remplissage vasculaire, amines vasopressives...).
Tous nos patients ont bénéficié au cours de leur prise en
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
1
/
7
100%