Figure 1 - Centre Imagerie du Nord

doi:10.1684/stv.2014.0852
Pour citer cet article : Sénéchal Q, Izzillo R, Teriitehau C, Besse F. L’anesthésie du membre supérieur par bloc du plexus brachial : un geste radiologique. Sang Thrombose Vaisseaux
2014 ; xx(x) : 1-7 doi:10.1684/stv.2014.0852 1
Mini-revue
Sang Thrombose Vaisseaux 2014 ;
xx, nox : 1-7
L’anesthésie du membre supérieur par bloc du plexus
brachial : un geste radiologique
Q. Sénéchal, R. Izzillo, C. Teriitehau, F. BesseQ1
Centre cardiologique du Nord, service de radiologie interventionnelle, Saint-DenisQ2
Résumé. La prise en charge de la douleur dans un bloc de radiologie
interventionnelle est très variable en fonction des pathologies traitées
et des intervenants. Nous avons instauré et évalué dans notre centre la
faisabilité de la réalisation d’un bloc du plexus brachial par le radiologue
dans la prise en charge des abords vasculaire d’hémodialyse. Le bloc
sus-claviculaire sous contrôle échographique sans stimulation avec 7 à
10 m de lidocaïne (Xylocaïne®2 %) s’est avéré le plus approprié à
notre pratique. Il a donné sur une évaluation de 100 patients consécutifs
hospitalisés pour le traitement d’un AVH le meilleur score sur l’échelle de
la douleur toutes techniques d’anesthésies confondues.
Mots clés : Q3
Abstract
Upper limb anesthesia with brachial plexus block: a radiological proce-
dure
Pain management in interventional radiological unit is variable, depen-
ding on the procedures and physicians. We have evaluated plexus
brachial block for percutaneous treatment of hemodialysis vascular
access in our unit. Ultrasound-guided supraclavicular block without sti-
mulation, with 7 to 10 mL of lidocaïne (Xylocaïne 2%), was the most
appropriate procedure. We evaluated the different analgesic proce-
dures with 100 consecutives inpatients for percutaneous treatment of
hemodialysis vascular access.
Key words: interventional radiology, ultrasound supraclavicular nerve blocks, upper
limb blockage, haemodialysis fistulas
Les gestes endovasculaires percutanés portant sur
les abords vasculaires d’hémodialyse (AVH)
peuvent être très douloureux. Les patients sou-
vent confrontés à de fréquentes réinterventions
doivent pouvoir envisager un nouveau geste avec sérénité.
Cependant, de nombreux obstacles sont susceptibles de
s’opposer à l’anesthésie conventionnelle lors de ces inter-
ventions réalisées en ambulatoire. De ce fait, la prise en
Tirés à part :
charge de la douleur varie notablement d’un centre à l’autre,
d’un patient à l’autre, et même d’un moment à l’autre
dans un même service. Les interventions sur les AVH
sont régulièrement réalisées dans un contexte d’urgence
ou de semi-urgence, entre deux séances d’épuration,
chez des patients volontiers polypathologiques dont les
paramètres physiologiques sont régulièrement perturbés
(K+).
La prise en charge « aléatoire » de la douleur, avec une
grande variabilité des moyens mis en œuvre selon les inter-

2STV, vol. xx, nox, xxxx 2014
Tableau 1. Répartition par classe de douleur : 96/100 (2 refus d’anesthésie, 2 non interrogeables)
0à1 2à4 5à8 9 à 10 Total
Sans anesthésiste 27 (53 %) 18 (35 %) 6 (12 %) 0 51
dont bloc 10 (83 %) 2 (17 %) 0 0
Avec anesthésiste 28 (62 %) 14 (31 %) 3 (7 %) 0 45
55 32 9 96
venants, les jours, les heures, nous a incités à rechercher
des alternatives à l’anesthésie conventionnelle.
Le mélange équimolaire oxygène-protoxyde d’azote
(MEOPA) au masque seul ou associé au midazolam
(Hypnovel®) donne des résultats variables, mais souvent
acceptables, pour des gestes simples réalisés chez des
patients raisonnablement compliants.
Mais cette technique a pu être prise en défaut en fonction
de la complexité du geste, de sa durée et de la psycholo-
gie du patient. Aussi avons-nous développé l’usage du bloc
tronculaire du membre supérieur (BMS), effectué par le
radiologue sous contrôle échographique. Cette technique,
très efficace sur la douleur, est rapide à mettre en œuvre et
son délai d’action est très court (5 minutes). Elle est réalisée
après une simple prémédication et ne présente pas de contre-
indication notamment liée aux troubles de l’hémostase ou à
l’insuffisance rénale. Elle permet un retour immédiat en dia-
lyse. Elle a l’avantage d’entraîner une vasodilatation avec
une augmentation du débit de la FAV [1]. Il est intéressant de
noter que les complications spécifiques neurologiques péri-
phériques sont plus fréquentes après anesthésie générale
qu’après anesthésie locorégionale (ALR).
Nous avons réalisé une évaluation de la douleur lors de
gestes effectués sur les AVH de 100 patients consécutifs
du 19 août au 6 octobre 2013. Nous avons eu recours à
l’anesthésie la plus adaptée ou à défaut la plus disponible
avec l’aide d’un anesthésiste ou sous la seule responsabilité
du radiologue. L’infirmière de la salle de réveil a recueilli
la perception de la douleur par le patient sur une échelle
de 0 à 10. 53 hommes pour 47 femmes d’une moyenne
d’âge de 63 ans (29 à 89 ans) ont été traités consécu-
tivement. Les AVH étaient : 38 radiales, 5 cubitales, 27
céphaliques, 27 basiliques et 3 pontages. 21 ont été traités
pour une occlusion aiguë, 2 pour des occlusions centrales
chroniques, 50 présentaient des sténoses entraînant une
hyperpression et 27 se présentaient pour un bas débit dont
5 avec une sténose artérielle. 46 % des patients ont été pris
en charge par un anesthésiste, 40 selon un protocole rémi-
fentanil (Ultiva®) à la SE dont un avec ajout de midazolam
(Hypnovel®) et un de propofol (Diprivan®). 6 ont béné-
ficié d’une analgésie par alfentanil (Rapifen®) associé au
midazolam. 52 % des patients ont été gérés par l’équipe de
radiologie interventionnelle sans anesthésiste. 12 patients
avec des abords compliqués ou occlus ont eu un bloc sus
claviculaire sous contrôle échographique sans stimulation
avec 7 à 10 m de lidocaïne (Xylocaïne®2 %). 7 d’entre
eux ont rec¸u en plus du MEOPA (Entonox®) pendant la
procédure. Le MEOPA au masque a été utilisé de première
intention pour 40 patients avec pour 13 patients une injec-
tion de1à2mgdemidazolam en raison d’agitation ou pour
améliorer l’analgésie. 2 patients ont refusé toute analgésie.
La moyenne sur l’échelle de douleur était de 1,42 (0-5)
lorsque la prise en charge était assurée par les anesthé-
sistes (avec Ultiva : 1,74 ; avec neuroleptanalgésie : 1,26).
Lorsque la prise en charge était assurée par les radiologues,
la moyenne était de 1,90 (0-8). Le MEOPA seul obtenait une
moyenne de 2,6. Mais surtout le BNP obtenait le meilleur
score toutes techniques confondues avec une moyenne de
0,83 (tableau 1).
Aucune complication, quelle que soit la méthode employée,
n’a été à déplorer.
Aucune corrélation entre le niveau de la douleur et le type
de fistule, le type de lésion ou la localisation de la lésion n’a
été retrouvée. Sur les 9 qui ont déclaré avoir une douleur ≥
5, il y avait 8 hommes et 1 femme.
Cette série de la « vraie vie », prospective, avec recueil
complet de l’information comporte une faible cohorte et
de nombreux biais, l’absence de randomisation rend les
sous-groupes non analysables, cependant elle reflète les
aléas de la prise en charge de la douleur dans cette acti-
vité ambulatoire. Elle renforce notre conviction qu’il existe
des solutions pouvant être mises en œuvre par le radio-
logue interventionnel. Le BNP est une réponse parfaitement
adaptée à la maîtrise de la douleur lors des gestes de revas-
cularisation des AVH.
Cette ALR nécessite dans tous les cas une information du
patient lui permettant de l’accepter ou de la refuser. La prise
en charge en urgence des occlusions des AVH ne permet pas

STV, vol. xx, nox, xxxx 2014 3
Figure 1. Repérage échographique des troncs nerveux.
d’accorder au patient de délai de réflexion mais ne dispense
pas de lui fournir les éléments d’information. En l’absence
de contexte d’urgence, l’information doit être donnée par le
radiologue lors de la consultation préalable dans les jours
précédant l’acte.
Le BMS est réalisé en salle de radiologie interventionnelle
après désinfection en deux temps de l’ensemble du membre
supérieur et du cou et mise en place des champs opératoires.
L’asepsie doit être rigoureuse : port de masque, coiffe,
casaque et gants stériles pour tous les intervenants, sonde
d’échographie protégée par une gaine stérile (figure 1).
Nous utilisons5à10mLdeproduit anesthésiant (lidocaïne
20 mg/mL adrénalinée 0,005 mg/mL) en injections lentes
et fractionnées après vérification de l’absence de reflux
sanguin.
L’efficacité du bloc doit être vérifiée avant le début de la
procédure interventionnelle et complétée si nécessaire par
une autre technique d’anesthésie en cas d’échec.
Le geste qui consiste à cibler la gaine du nerf nécessite
l’utilisation d’aiguilles à biseau court (30◦) pour réduire le
risque de lésions nerveuses. Il existe des aiguilles à biseau
court échogène qui améliorent la visibilité et la précision
du geste.
Les injections intraneurales génèrent des douleurs impor-
tantes, immédiates et retardées, une injection lente et
fractionnée permet de repositionner l’aiguille et d’éviter
les complications à type de paresthésie [2].
Le guidage par échographie permet de diminuer la quantité
d’anesthésiant injecté et d’éviter le risque d’injection intra-
vasculaire. La supervision par l’échographie de l’injection
permet de détecter l’injection intraneurale, le bon position-
nement de l’aiguille et de s’assurer de la bonne répartition
de l’anesthésiant autour de la gaine du nerf. Il est possible
de déplacer l’aiguille en cours d’injection afin d’optimiser
la dispersion de l’anesthésique pour englober le nerf.
L’injection intraneurale peut être asymptomatique, elle se
repère par une augmentation du diamètre de la gaine qui
devient moins échogène [3].
Riazi [4] a montré pour l’analgésie postopératoire de
l’épaule que la réduction de volume d’anesthésique local
injecté de 20 mL à 5 mL en bloc interscalénique n’a pas
entraîné de différences dans les scores de douleur, la durée
du bloc ou la consommation de morphine en postopératoire.
O’Donnell [5] a étudié la quantité minimale d’anesthésique
local efficace en diminuant progressivement les doses. Par-
tant d’une dose initiale de 5 mL de lidocaïne 2 % adrénalinée
par nerf (médian, radial, ulnaire, musculo-cutané), l’auteur
diminue progressivement le volume d’anesthésique local
utilisé après chaque série de 5 blocs axillaires consécutifs
réussis. Il montre que 1 mL d’anesthésique local placé au
contact des nerfs, sans injection intraneurale, permet un
succès constant de la technique. Le taux de succès dépend
donc plus de la précision de l’injection que du volume
d’anesthésique local utilisé.
Dans notre expérience, 5 mL de lidocaïne adrénalineà2%
suffisent pour les interventions pouvant dépasser la demi-
heure.
Un examen neurologique avant la réalisation du BNP et
avant la sortie du patient est nécessaire et doit être reporté
sur un compte-rendu.
Le radiologue interventionnel possède les connaissances
anatomiques et échographiques nécessaires au repérage
des nerfs et des vaisseaux permettant de réaliser une
injection ciblée et contrôlée. L’évaluation de l’efficacité
du geste est immédiate.
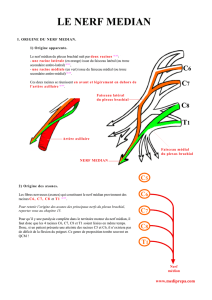
Rappel anatomique du trajet
des nerfs du membre supérieur
Le plexus brachial innerve la totalité du membre supérieur.
Il est formé des racines nerveuses des nerfs spinaux C5 à
Th1 et de deux contingents provenant de C4 et de Th2.
L’union de ces racines va former trois troncs primaires :

4STV, vol. xx, nox, xxxx 2014
supérieur, moyen et inférieur dans le sillon interscalénique,
localisés entre le scalène antérieur et le scalène moyen,
ces chefs musculaires étant postérieurs au muscle sterno-
cléido-mastoïdien. Le tronc supérieur C5 C6 chemine
au-dessus de l’artère sous-clavière, il innerve principale-
ment la racine du membre supérieur, les muscles de l’épaule
et les muscles du bras. Le tronc moyen C7 innerve princi-
palement la face postérieure du bras, la partie latérale de
l’épaule et la totalité des muscles extenseurs de l’avant-
bras et des doigts. Le tronc inférieur C8 Th1 innerve une
partie de l’avant-bras, mais surtout la main.
Chaque tronc se divise en se dirigeant vers l’apex de la
région axillaire en branche antérieure et postérieure. La
branche antérieure du tronc supérieur se réunit avec la
branche antérieure du tronc moyen pour former le faisceau
latéral. La branche antérieure du tronc inférieur forme à
elle seule le faisceau médial. Les 3 branches postérieures
forment le faisceau postérieur du plexus brachial.
Plus distalement, le plexus brachial chemine avec les artères
sous-clavière et axillaire dans une gaine de tissu conjonctif.
Enfin, les 3 faisceaux se divisent dans la fosse axillaire pour
former les nerfs destinés au membre supérieur :
– le faisceau postérieur donne 2 troncs nerveux : nerf axil-
laire, nerf radial ;
– le faisceau latéral donne 2 branches, le nerf musculo-
cutané, ainsi que la racine latérale du nerf médian ;
– le faisceau médial donne 2 branches, d’une part la racine
médiale du nerf médian et le nerf ulnaire.
Le faisceau médial donne des rameaux nerveux sensitifs
comme le nerf cutané médial du bras et celui de l’avant-bras.
La connaissance de l’anatomie du plexus brachial permet de
choisir le type de bloc à réaliser en fonction de la localisation
de l’abord vasculaire et du geste thérapeutique envisagé.
L’innervation du membre supérieur est complexe et il
est important de distinguer l’innervation cutanée (derma-
tomes), musculaire (myotomes) et osseuse (ostéotomes).
La sensibilité des territoires cutanés et sous-cutanés dépend
des ramifications terminales des nerfs médian, ulnaire,
radial, musculo-cutané et cutané médial du bras et de
l’avant-bras. La région de l’épaule est principalement inner-
vée par le plexus cervical superficiel, seul le moignon et la
partie supéro-externe sont innervés par le nerf axillaire. La
face antéro-interne du bras est innervée par une branche
du nerf cutané latéral du bras, alors que la face interne de
l’avant-bras est innervée par le nerf cutané latéral de l’avant-
bras. Aucun des troncs nerveux profonds (ulnaire, radial et
médian) ne donne au niveau du coude, de rameau nerveux
cutané pour l’avant-bras.
Une étude [6] a comparé l’extension de l’anesthésie en fonc-
tion de différents abords du plexus brachial (figure 2).La
technique de repérage n’était pas standardisée et utilisait,
AB
CD
Figure 2. Extension de l’ anesthésie des blocs interscalénique
(A), supraclaviculaire (B), infraclaviculaire (C) et axillaire (D). Noir
plus de 80 %, gris 60 à 80 % et blanc moins de 60 %. D’après [6].
soit la recherche de paresthésies, soit la neurostimulation.
Le taux de réussite dans les différents territoires aurait pro-
bablement été amélioré par l’échoguidage. L’étendue du
bloc anesthésique est variable selon le site d’injection de
l’anesthésique local ; si les blocs interscaléniques peuvent
être envisagés pour les fistules radiales et céphaliques, ils
ne sont que peu utiles pour les autres AVH.
Dans notre pratique, nous ne faisons pratiquement plus
que des blocs supraclaviculaires qui ont le double avantage
d’être faciles à réaliser et de répondre à tous les AVH.
Le bloc interscalénique (figure 3)
Les racines du plexus brachial sont dans le sillon inter-
scalénique, entre le scalène antérieur et le scalène moyen, à
hauteur du cartilage cricoïdien. Le sillon interscalénique est
généralement trouvé immédiatement latéral au bord externe
du muscle sterno-cléido-mastoïdien.
La voie d’abord d’injection doit être latérale externe, super-
ficielle et ciblée de manière à minimiser le risque de

STV, vol. xx, nox, xxxx 2014 5
Figure 3. Bloc interscalénique droit par voie latérale dans le plan
de la sonde d’échographie.
ponction vasculaire accidentelle et de diminuer le risque
de constitution d’un bloc récurrentiel, phrénique ou du
ganglion cervical inférieur (stellaire) respectivement res-
ponsable d’une paralysie laryngée, d’une diminution de
la ventilation et du syndrome de Claude Bernard-Horner,
habituellement transitoires, fréquemment observés après un
bloc interscalénique non échoguidé avec une importante
quantité d’anesthésiant. L’échographie permet la localisa-
tion les trois troncs primaires et donc de diminuer le nombre
de blocs partiels.
Le bloc supraclaviculaire (figures 4, 5, 6, 7,
8, 9)
Il bloque le plexus brachial au niveau des troncs nerveux.
C’est le plus adapté pour les abords vasculaires
d’hémodialyse en raison de son efficacité sur la totalité du
trajet des veines radiales, cubitales, basiliques, humérales,
céphalique et axillaire. Dans notre expérience il semble être
efficace également en cas d’angioplastie de la veine sous-
clavière. Il nécessite très peu d’anesthésique (5 à 10 mL) et
une ponction unique.
Le patient est en décubitus dorsal, la tête tournée à 45◦
du côté controlatéral. Une voie latérale dans le plan de
la sonde positionnée dans la fosse sus-claviculaire permet
une approche tangentielle au plexus brachial, ce qui mini-
mise les risques de ponction vasculaire et de pneumothorax.
Les troncs ou les divisions du plexus brachial prennent la
forme de structures hypoéchogènes rondes ou ovales, sou-
vent encerclées de tissu hyperéchogène, et s’observent le
Figure 4. Ponction latérale dans l’axe de la sonde en sus-
claviculaire.
1
243
Figure 5. Repérage des racines du plexus brachial dans le sillon
interscalénique, en dehors du muscle sterno-cléido-mastoïdien (1)
entre le scalène antérieur (2) et le scalène moyen (3) quelques cen-
timètres en dehors de la veine jugulaire interne et de la carotide.
Les racines nerveuses ou les troncs nerveux (4) se présentent sous
la forme d’images rondes hypoéchogènes dans le défilé intersca-
lénique. Il faut alors suivre les troncs en descendant la sonde dans
la fosse sus-claviculaire.
plus souvent dans une position latérale et superficielle à
l’artère sous-clavière. La diffusion de l’anesthésique local
doit entourer les nerfs ciblés. Si la diffusion est latéralisée,
il faut repositionner l’aiguille.
Précautions
Le déclenchement d’une paresthésie doit faire stopper la
progression de l’aiguille pour éviter le risque de blessure
nerveuse. Les injections intraneurales peuvent générer des
douleurs importantes, immédiates ou retardées imposant
le recul de l’aiguille même si les dernières publications
 6
6
 7
7
1
/
7
100%