ALR de l`épaule : quelle(s)

ALR DE L’ÉPAULE : QUELLE(S) TECHNIQUE(S)
POSSIBLE(S), POUR QUELLE(S) CHIRURGIE(S)
Laurent Delaunay (1), Laurent Lafosse (2), Florence Plantet (3)
(1) Département d’anesthésie, (2) Département d’orthopédie : Clinique Générale
Annecy, 4 chemin de la Tour la Reine, 74 000 Annecy, France. (3) Département
d’anesthésie : Centre Hospitalier Régional, 1 avenue du Trésum, 74000 Annecy.
INTRODUCTION
La chirurgie de l’épaule est en train de devenir une spécialité à part entière
au sein de l’orthopédie. L’évolution des techniques et plus particulièrement de
l’arthroscopie permet de prendre en charge des pathologies de plus en plus
complexes et de proposer des traitements réellement curatifs et non plus
seulement antalgiques. L’anesthésie locorégionale semble incontournable dans
cette indication bien qu’aucune étude de niveau I (selon les critères d’« Evidence
Based Medicine ») n’ait confirmé sa supériorité pour le peropératoire comparé
à l’anesthésie générale. Par contre, concernant la prise en charge de la douleur
postopératoire l’intérêt des blocs périphériques en injection unique et surtout
continue est indéniable.
Le but de cette revue, après quelques rappels d’anatomie, est de présenter
les différents « outils » anesthésiques possibles ainsi que les principales tech-
niques chirurgicales de l’épaule et de proposer des indications.
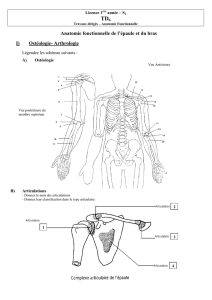
1. ANATOMIE
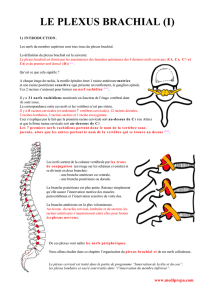
1.1. LE PLEXUS BRACHIAL
Le plexus brachial est un complexe anastomotique issu des racines anté-
rieures C5 à D1. Il assure l’innervation de la ceinture scapulaire et de tout le
membre supérieur [1-3]. Il a une forme triangulaire dont la base repose sur
le rachis cervical et la pointe répond à l’apex du creux axillaire. Les racines
C5-C6 forment le tronc supérieur, C7 le tronc moyen et C8-D1 le tronc inférieur.
Habituellement les racines antérieures de C4 et de D2 contribuent au plexus
brachial. Cette contribution permet de différencier les plexus préfixés possé-
dant une contribution plus importante de C4 des plexus post fixés avec une
contribution D2 prédominante [4]. Ces différences peuvent expliquer au moins
en partie les différences d’extension observées après un bloc interscalénique.

MAPAR 2005
62
Une répartition métamérique de l’innervation sensitive se retrouve facilement
au niveau du membre supérieur tel que l’ont montrée Foerster en 1933 puis
Keegan en 1948 [3]. A cette répartition métamérique de l’innervation cutanée
extrêmement variable avec de nombreux territoires de recouvrement répond
une stricte répartition musculaire en 2 plans un antérieur (flexion – pronation)
et un postérieur (extension - supination). Cette séparation apparaît au niveau
des faisceaux (2 faisceaux antérieurs et un faisceau postérieur) dans la région
rétroclaviculaire.
Dans la région susclaviculaire, le plexus brachial donne 12 branches, certai-
nes sont intéressantes à connaître pour une approche plus rationnelle et une
meilleure compréhension de l’ALR :
• Le nerf thoracique long qui innerve le muscle grand dentelé (muscle inspira-
toire s’insérant sur les premières côtes) naît directement des racines C5 à C7,
il est postérieur au plexus brachial. Il est fréquent de stimuler ce nerf lors de
la réalisation d’un bloc interscalénique
• Le nerf dorsal de la scapula (C5) qui innerve les muscles élévateurs de l’omo-
plate est l’une des premières branches à quitter le plexus, il correspond à la
partie supérieure du plexus brachial. C’est celui-ci que l’on recherche si l’on
souhaite une extension maximale de l’anesthésie vers les plexus cervicaux
(par exemple pour la chirurgie carotidienne) [5].
• Le nerf supra scapulaire (C5-C6) qui quitte le plexus brachial dans la région
interscalénique innerve les muscles sus et sous épineux et surtout une partie
importante de la capsule articulaire de l‘épaule. Un bloc plexique en dessous
du sillon interscalénique (supra claviculaire) pourra être insuffisant pour assurer
une anesthésie de toute l’articulation de l’épaule.
• Les nerfs pectoral latéral (C5-C6) et sous scapulaire supérieur (C5-C6) qui,
outre une innervation éponyme, donnent des rameaux nerveux pour la capsule
articulaire de l’épaule.
• Le nerf sub-clavier qui innerve le muscle sub-clavier s’anastomose systé-
matiquement avec le nerf phrénique. Cela pourrait expliquer qu’une atteinte
diaphragmatique au moins partielle est toujours possible avec des blocs supra
claviculaires même sans extension au nerf phrénique.
1.2. L’INNERVATION SUPERFICIELLE ET PROFONDE DE L’ÉPAULE [6]
L’innervation cutanée dépend principalement des branches inférieures du
plexus cervical superficiel (nerf sus claviculaire) dont le territoire s’étend jus-
qu’à la partie supérieure du moignon de l’épaule [7]. Le reste du moignon de
l’épaule est innervé par le nerf axillaire. Au-delà du sillon delto-pectoral en avant
et au niveau du grand dorsal en arrière, l’innervation est assurée par les nerfs
intercostaux issus des racines T1 et surtout T2. La région postérieure paraverté-
brale est innervée par les nerfs issus de racines postérieures cervicales. Cette
répartition des différents territoires est en fait variable et il existe des zones de
recouvrements imprévisibles particulièrement au niveau de la face postérieure
de l’épaule.
En ce qui concerne l’innervation musculaire, pratiquement tous les muscles
de l’épaule (coiffes des rotateurs C5-C6, deltoïde C5-C6, pectoraux C5-T1 et
grand dorsal C6-C8), sont innervés par le plexus brachial. Seul le trapèze, qui
est un puissant élévateur du moignon de l’épaule (surtout chez le sportif), est
innervé en partie par le plexus cervical mais surtout par le nerf spinal (onzième
paire crânienne ou nerf accessoire).

ALR 63
L’innervation osseuse dépend du nerf axillaire pour la face antérieure (C5-C6),
supra scapulaire (C4-C6) et thoracique long (C5-C7) pour les faces antérieures
et postérieures [8]. L’innervation articulaire de l’épaule dépend pour la capsule
antérieure de branches des nerfs subscapulaire (C5-C7), axillaire (C5-C6) et pec-
toral latéral (C5-C6) et pour la partie postérieure essentiellement du nerf supra
scapulaire (C4-C6) associé à quelques rameaux du nerf axillaire (C4-C6) [3, 9].
En résumé, il est simple de constater le rôle primordial et presque exclusif des
racines C5-C6 dans l’innervation sensitive de l’épaule. En conséquence quelle
que soit la technique de bloc choisi, l’objectif doit être de bloquer ces racines
généralement en recherchant le tronc supérieur. Par contre un relâchement
musculaire complet, parfois indispensable dans certaines chirurgies, sera difficile
à obtenir. D’abord parce que le trapèze ne sera jamais bloqué par un bloc du
plexus brachial et d’autre part parce que les racines les plus profondes participent
à l’innervation des muscles pectoraux et dorsaux et peuvent « échapper » à un
bloc interscalénique.
1.3. LA RÉGION INTERSCALÉNIQUE
Le muscle omo-hyoïdien permet de délimiter 2 triangles, un triangle omo-
claviculaire où peuvent être réalisés les différents blocs supraclaviculaires et
un triangle omo-trapézien dans lequel on retrouve le sillon interscalénique [10].
L’ensemble du plexus brachial ainsi que les structures vasculaires jusqu’à la
région axillaire sont entourés d’une « gaine », cette gaine étant constituée par
les aponévroses musculaires et les différents fascias qui entourent ces struc-
tures. Contrairement à ce qui a été longtemps suggéré cette gaine ne doit pas
être considérée comme un tube étanche, que l’on peut remplir et dans lequel
on pourrait faire varier l’extension de l’anesthésie par un simple jeu de com-
pression [11]. En pratique il est préférable de parler d’espace de diffusion plutôt
que de gaine.
Au niveau du défilé interscalénique, on retrouve les différentes composantes
du plexus brachial disposées en pile d’assiettes. En haut de la pile, se trouvent
les racines supérieures C5 et C6 puis C7 et enfin, profondément située en arrière
des vaisseaux sub-claviers et au contact du dôme pleural, les racines inférieures
C8 et D1. Des variations anatomiques ont été décrites, une partie du plexus
brachial peut notamment passer au travers, voire en avant, du muscle scalène
antérieur. Il a également été décrit une lame musculaire tendue entre les mus-
cles scalènes séparant les 2 racines supérieures de la partie inférieure du plexus
brachial [12]. L’empilement des racines et ces variations anatomiques expliquent
pourquoi l’extension de l’anesthésie à l’ensemble du plexus brachial est incons-
tante après un bloc interscalénique. Par contre les racines C5 et C6, dont nous
rappelons encore une fois le rôle prépondérant dans l’innervation sensitive de
l’épaule, restent les plus accessibles lors d’une approche interscalénique.
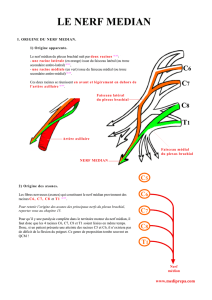
La figure 1 représente une coupe transversale du cou au niveau de l’isthme
thyroïdien. Elle permet de visualiser la situation du plexus par rapport aux structu-
res environnantes. Compte tenu de leur faible profondeur, il est possible, même
avec des aiguilles de 5 cm, de ponctionner l’artère vertébrale ou de pénétrer
un trou de conjugaison en cas de trajet strictement médiale de l’aiguille. La
proximité du ganglion cervical inférieur explique la fréquence des syndromes
de Claude Bernard Horner (CHB). Enfin la situation du nerf phrénique explique
la fréquence élevée (en fait quasi systématique) de parésie diaphragmatique
homolatérale., bien que la parésie phrénique dans ce cas soit plutôt liée à une

MAPAR 2005
64
diffusion ascendante vers le plexus cervical et au bloc du nerf sub-clavier.
Une
réponse du nerf phrénique
lors de la neurostimulation témoigne d’une position
trop antérieure de l’aiguille, à l’opposé une stimulation des nerfs suprascapulaire
et/ou thoracique suggèrent une position trop postérieure. Notez la situation de
la veine jugulaire externe qui, située en avant du plexus brachial, peut servir de
repère quand le sillon interscalénique est difficile à palper.
Figure 1 : Coupe de la région cervicale au niveau de l’isthme thyroïdien.
1) ganglion cervical inférieur, 2) nerf phrénique, 3) nerfs supra scapulaire et thora-
cique long, 4) plexus brachial, 5) veine jugulaire externe, 6) racine C8, 7) muscle
scalène antérieur, 8) muscle scalène postérieur, 9) artère vertébrale
Connaître la somatotopie des fibres nerveuses au niveau des troncs permet
de comprendre les réponses obtenues en neurostimulation.
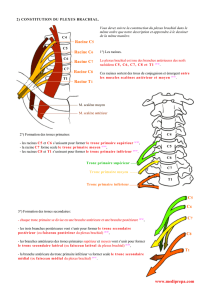
La figure 2, que l’on doit à Denis Jochum à partir des travaux d’Alnot, montre
qu’une contraction des muscles deltoïde, du biceps brachial, et/ou du brachial
correspondent à une stimulation des racines C5 et C6 [13, 14]. Une contraction
des extenseurs (triceps, muscle fléchisseur, extenseurs du poignet peut corres-
pondre à une stimulation du tronc supérieur mais également à une stimulation
de la racine C7. En effet, une étude faite sur 2 patients opérés d’un syndrome du
défilé a montré que seule la stimulation du tronc moyen (C7) permettait d’obtenir
une contraction du triceps [15].
Un mouvement de flexion des doigts doit faire suspecter une stimulation du
tronc inférieur pouvant témoigner du positionnement trop caudal de l’aiguille qui
se trouve alors à proximité du dôme pleural.

ALR 65
2. LES DIFFÉRENTES TECHNIQUES D’ANESTHÉSIE
Dans l’enquête 3 jours, 77 % de la chirurgie de l’épaule était réalisée sous
anesthésie générale associée dans 15 % des cas à une ALR et seulement 8 %
sous ALR seule [16]. Même s’il est vraisemblable que ces chiffres ont dû évo-
luer depuis 1996, il semble que, malgré une efficacité reconnue, l’anesthésie
locorégionale soit largement sous-utilisée dans cette indication.
2.1. TECHNIQUES D’ANESTHÉSIE LOCORÉGIONALE
Différentes techniques ont été proposées pour aborder le plexus brachial dans
la région interscalénique. L’analyse de la littérature retrouve plusieurs auteurs
ayant proposé leur voie et leurs repères avec des variantes plus ou moins clini-
quement pertinentes [17-22]. En pratique, il est possible de simplifier les choses
en partant de l’anatomie de la région et de considérer 3 approches possibles.
L’approche antérieure et une approche postérieure approche directe classique.
La voie antérieure ou inter-sterno-cleido-mastoidienne a été proposée par
Pham Dang [19]. Le point d’introduction se situe dans le triangle formé par les
2 chefs du muscle sterno-cléido-mastoïdien (triangle de Sedillot). L’aiguille est
introduite 3 cm au-dessus de la fourchette sternale et passe sous le chef clavicu-
laire du SNC en visant le milieu de la clavicule homolatérale. L’intérêt de ce bloc
pour ses auteurs est d’aborder le plexus de façon tangentielle ce qui faciliterait
l’introduction du cathéter. D’autre part il serait possible de rechercher une réponse
des troncs inférieurs (flexion des doigts) qui pourrait pour les auteurs limiter le
risque de paralysie phrénique [23]. Cette voie a un intérêt didactique certain, car
il semble aisé de pouvoir localiser le tronc (supérieur, moyen, inférieur) de son
choix simplement en mobilisant l’aiguille dans l’axe crânio-caudal. Néanmoins
Figure 2 : Systématisation du plexus brachial, dessin de Denis Jochum d’après
Y Alnot [13]. A : nerf axillaire, MC : nerf musculo-cutané, R : nerf radial, M : nerf
médian, SC : nerf suprascapulaire
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%