MECANISMES REACTIONNELS

ANNEE ACADEMIQUE 2015 – 2016
1
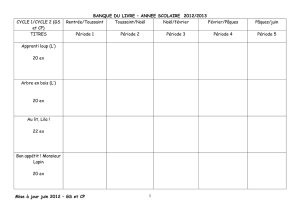
SYLLABUS DU COURS DE L’UE CHM 306
MECANISMES REACTIONNELS
Faculté des Sciences
Faculty of Sciences
Université de Yaoundé I
University of Yaoundé I
DEPARTEMENT DE CHIMIE ORGANIQUE
Department of Organic Chemistry
Equipe pédagogique
: Pr YANKEP, Dr NOTE

ANNEE ACADEMIQUE 2015 – 2016
2
Le cours de l’UE CHM 306 de L3 de Chimie porte sur deux parties essentielles : les réactions d’actions sur
la fonction carbonyle présente dans les cétones, aldéhydes et acides carboxyliques et dérivés ; la deuxième
partie porte sur les réactions de réarrangement ou de transposition impliquant un atome de carbone (C),
d’oxygène (O) ou d’azote (N) avec mise en jeu du déplacement d’un groupement et départ conséquent d’un
autre.
Dans la première partie,
Concernant les aldéhydes, on note trois types d'attaques possibles dues à la fonction carbonyle
:
A : Attaque d'électrophile.
B : Attaque de nucléophile, celle d'un magnésien par exemple.
C : Attaque d'une base.
De même pour les cétones on a :
Attaque électrophile Attaque nucléophile
Lorsque l'on déprotone en α d'un carbonyle, il existe deux façons de représenter l'anion formé
:
De ces deux façons possibles de représenter l'anion, la forme B est la forme privilégiée, c'est-
à-dire la forme sur laquelle la charge négative est présente sur l'atome d'oxygène (c'est-à-dire
l'atome le plus électronégatif) et non l'atome de carbone.

ANNEE ACADEMIQUE 2015 – 2016
3
Les principales réactions présentées dans ce cours de l’UE CHM 306 concernées par la réactivité de la
fonction carbonyle sont :
1) Addition du réactif de Grignard:
à partir du méthanal on obtient un alcool primaire
à partir d'un aldéhyde on obtient un alcool secondaire
à partir d'une cétone on obtient un alcool tertiaire.
2) Addition d'un alcynure:
3) Réaction avec les amines
Amines I :
Amines II :
Amines III : Pas de réactions possible.

ANNEE ACADEMIQUE 2015 – 2016
4
4) Réaction de Strecker
5) Réaction de Réformatski
6) Réaction de Wolff Kishner
7) Réaction de Wittig
.
8) Action du diazométhane
9) Action de l'hydroxylamine (NH2OH)
10) Réaction de Baylis-Hillman

ANNEE ACADEMIQUE 2015 – 2016
5
11) Réaction de Shapiro
12) Réactions d’alkylation
En milieu basique
Au cours de la réaction, on observe une α-élimination., si on utilise une base forte
En milieu acide
Le premier composé formé est un aldol (fonctions alcool et aldéhyde, si R1 = H), le composé
final est le produit de crotonisation.
Addition de Michael
L'addition de Michael est une réaction très important, elle se fait entre une cétone conjuguée
(α,β-insaturé), et une forme énol obtenue par EtONa par exemple.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%