Pneumothorax - Swiss Medical Forum

CABINET Forum Med Suisse No9 27 février 2002 202
Introduction
De l’air introduit dans l’espace pleural pro-
voque le collapsus du poumon. Le tissu pulmo-
naire est normal lors du pneumothorax pri-
maire ou l’on trouve quelques petites bulles
sous-pleurales appelées «blebs» qui peuvent
sauter. On parle de pneumothorax secondaire
lors de pathologies du parenchyme pulmonaire
p.ex. un emphysème pulmonaire, une Hystio-
cytose X, ou de fibrose cystique. Les récidives
dues à des fistules broncho-pleurales persis-
tantes sont fréquentes lors de lésions pulmo-
naires préalables. Il existe aussi des pneumo-
thorax iatrogènes et traumatiques.
Selon son étendue on parle de pneumothorax
partiel ou complet. Un pneumothorax sous ten-
sion (par un mécanisme de valve) peut entra-
ver le retour veineux au cœur et représenter ra-
pidement une menace vitale.
Le traitement du pneumothorax est peu stan-
dardisé et n’est guère étayé par des études
prospectives.
Types de manifestation
Le pneumothorax spontané primaire
Le pneumothorax spontané primaire survient
avec une incidence entre 7,4 et 18 cas par
100 000/an chez les hommes et une incidence
de 1,2 à 6 cas chez les femmes [1, 2]. Les
hommes minces et élancés sont les plus expo-
sés. La première manifestation survient entre
la dixième et la trentième année, un premier
épisode de pneumothorax spontané est rare
après quarante ans.
Dans une étude [3], 16 patients avec un pneu-
mothorax spontané primaire sur 20 avaient des
petites bulles apicales aussi appelées «blebs»
décelées au CT. 91% des cas étaient fumeurs
dans une étude compilant 505 patients avec
pneumothorax [4]. Fumer augmente linéaire-
ment jusqu’à 20 fois le risque de pneumothorax
spontané en fonction de la dose [5]. Mais le mé-
canisme d’apparition de «blebs» reste spécula-
tif. Il se pourrait que la fumée de tabac induise
les granulocytes neutrophiles et les macro-
phages à dégrader les fibres élastiques par des
protéases. Une fois les bulles formées, l’obs-
truction des voies respiratoires périphériques
due à l’inflammation provoque une élévation de
la pression intra-alvéolaire, entraînant une fuite
de l’air vers les interstices pulmonaires. L’air
diffuse vers les hiles, jusqu’au déchirement de
la plèvre pariétale médiastinale provoquant ainsi
un pneumothorax. Des examens histologiques
et au microscope électronique des résections
chirurgicales n’ont pas pu mettre en évidence
des ruptures de la plèvre viscérale au niveau
des «blebs» [6]. Une sur-pression apparaît
lorsque de l’air entre dans l’espace inter-pleu-
ral au niveau d’une rupture broncho-pleurale
mais ne peut le quitter en expiration en raison
d’un mécanisme de valve; elle peut provoquer
un déplacement controlatéral du médiastin avec
compression du poumon et pire encore avec une
compression du retour veineux. Une situation
de danger vital peut survenir avec collapsus car-
dio-vasculaire et insuffisance respiratoire (pneu-
mothorax sous tension).
Le pneumothorax spontané secondaire
Contrairement à l’évolution clinique habituelle-
ment bénigne du pneumothorax spontané pri-
maire, le pneumothorax spontané secondaire
est une menace vitale potentielle car le patient
ne dispose que de faibles réserves cardio-pul-
monaire en raison de la maladie pulmonaire.
Une pneumopathie obstructive chronique est à
l’origine de 69% des pneumothorax secon-
daires dans une étude israélienne portant sur
505 cas de pneumothorax secondaires [7]. Il faut
donc songer à l’éventualité d’un pneumothorax
lors de toute péjoration aiguë d’un COPD. La
deuxième cause la plus fréquente était une tu-
meur (18%), une sarcoïdose (5%), des pneumo-
nies à Pneumocystis-carinii lors d’infection HIV
et d’autres infections broncho-pulmonaires.
D’autres conditions rares pouvant se compli-
quer de pneumothorax sont l’Hystiocytose X et
la lymphangioleiomyomatose. Un pneumotho-
Pneumothorax
R. Thurnheer, K. Diema
Un pneumothorax est un évènement inquiétant pour les patients
concernés. Le poumon peut être réexpandu le plus souvent sans
problème. En cas d’échec, il faut rechercher la pathologie pulmonaire
sous-jacente.
aInnere Medizin FMH, Ettingen
Correspondance:
Dr Robert Thurnheer
Medizinische Klinik
Kantonsspital
CH-8596 Scherzingen

CABINET Forum Med Suisse No9 27 février 2002 203
rax peut survenir chez les patients intubés, par-
ticulièrement si des pressions de ventilation
élevées sont nécessaires.
Les pneumothorax lors de pneumopathie in-
terstitielle sont particulièrement probléma-
tiques, car la compliance réduite des poumons
entrave leur ré-expansion. Le «pneumothorax
cataménial» est un cas particulier. Il survient
typiquement chez les femmes de 30–40 ans
avec des antécédents d’endométriose durant
les 3 premiers jours des menstruations et
concerne surtout le poumon droit. Une endo-
métriose de la plèvre est à son origine. Le trai-
tement est hormonal, une pleurectomie peut
s’avérer nécessaire dans les cas rebelles.
Les pneumothorax spontanés secondaires sont
les plus fréquents entre 60–65 ans, parallèle-
ment à l’incidence de pneumopathies chro-
niques dans la population générale.
Diagnostic
Anamnèse, signes cliniques, radiologie
La présentation clinique fait suspecter un pneu-
mothorax [8], qui survient souvent au repos.
Une douleur thoracique aiguë dépendant de la
respiration et une dyspnée sont le mode de pré-
sentation le plus fréquent. Certains patients
évoquent le sentiment comme si quelque chose
se déplaçait dans le thorax. Une toux irritative
et une hémoptysie peuvent aussi survenir.
Comme la symptomatologie est parfois dis-
crète, il convient de songer au pneumothorax
lors de chaque douleur pulmonaire «atypique».
Un effort corporel, un éternuement ou un reni-
flement sont parfois des éléments déclen-
chants. Il est souvent possible de retrouver un
épisode antérieur à l’anamnèse. Des petits
pneumothorax partiels (<15% d’un hémi-tho-
rax) peuvent passer inaperçus cliniquement,
mais sont le plus souvent déjà bien visible à la
radio du thorax. Le thorax doit être effectué en
inspiration aussi lors de suspicion de pneumo-
thorax (voir ci-dessous). Le pneumothorax
étendu provoque une réduction de la mobilité
de la paroi du thorax, une hyper-sonorité à la
percussion est présente lors de pneumothorax
complet, de même que l’absence ou la diminu-
tion des son à l’auscultation. Une absence de la
transmission du frémissement de la voix au
côté atteint peut également suggérer un pneu-
mothorax.
Les signes d’alarmes pour un pneumothorax
sous tension sont: une tachycardie à plus de
120 p/min, une hypotension, une stase vei-
neuse jugulaire et un pouls paradoxal. Les
signes radiologiques d’un pneumothorax sous
tension sont un déplacement du médiastin et un
aplatissement de la coupole diaphragmatique
au coté atteint.
Influences sur les fonctions pulmonaire
et les échanges gazeux
L’examen des fonctions pulmonaire est contre-
indiqué lors d’un pneumothorax. Un pneumo-
thorax spontané primaire étendu diminue la
capacité vitale et élève le gradient alvéolo-arté-
riel. La ventilation diminuée du tissu pulmo-
naire perfusé provoque un shunt et donc une
hypoxémie. Une hypercapnie n’apparaît ce-
pendant pas si le reste des tissus pulmonaires
est sain. Une alcalose respiratoire aiguë est
souvent présente. Une hypoxémie sévère et une
hypercapnie sont fréquentes lors de pneumo-
thorax spontanés secondaires. Les autres
signes cliniques tels l’hyper-sonorité à la per-
cussion et la diminution unilatérale du mur-
mure vésiculaire souvent masqués par la ma-
ladie de base.
Traitement
Le traitement dépend de l’étiologie, de l’éten-
due et des symptômes du pneumothorax. Le but
est de faire disparaître l’air de l’espace pleural
pour permettre la ré-expansion du poumon et
de diminuer le risque de récidive. L’attitude thé-
rapeutique dépend de la sévérité du pneumo-
thorax et de ses symptômes, de la persistance
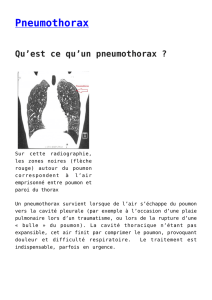
Figure 1.
Pneumothorax complet droit
(flèche noire) avec signes d’un
début de mécanisme de valve
(déplacement du médiastin à
gauche, aplatissement diaphrag-
matique (flèche blanche) chez un
patient tabagique de 56 ans avec
une BPCO connue.

CABINET Forum Med Suisse No9 27 février 2002 204
ou non d’une fuite d’air et de la maladie sous-
jacente. Une décompression en urgence s’im-
pose lors de pneumothorax sous-tension, p.ex.
avec un cathéter veineux de gros calibre au ni-
veau du 2eou 3eespace intercostal sur la ligne
médio-claviculaire.
Pneumothorax partiel asymptomatique
Le traitement est d’abord conservateur, ambu-
latoire ou stationnaire, si le pneumothorax oc-
cupe moins de 15% de l’hémi-thorax. Si l’on
opte pour un traitement stationnaire, un apport
d’oxygène par voie nasale peut accélérer la ré-
sorption d’air par augmentation du gradient de
pression partielle de l’azote.
Pneumothorax symptomatique
Un pneumothorax symptomatique avec une
étendue de plus de 15% (latéral >2 cm, apical
>3–5 cm) d’un hémi-thorax doit être drainé.
Cela peut être accompli par un ponction de
drainage unique avec un cathéter veineux [9].
L’air est alors aspiré avec une seringue avec un
robinet à trois voies et vidé dans une colonne
d’eau. D’après les données publiées cette tech-
nique a un taux de succès de 70% pour les pe-
tits pneumothorax [10]. Mais un drain pleural
posé sous condition aseptique reste le traite-
ment habituel. Comme la fuite d’air est souvent
minime, des drains thoraciques de relative-
ment petit-à moyen calibre (Ch 16–24) sont le
plus souvent suffisants [11, 12]. L’emploi de ca-
théters de Mathys de très fins calibre est à dé-
conseiller car ils peuvent se couder, sont insuf-
fisants pour évacuer assez d’air lors de fuite im-
portantes, et l’aiguille creuse peut provoquer
des blessures des vaisseaux sous-costaux, des
poumons et parfois même des organes de l’ab-
domen supérieur.
Aux USA les patients sont souvent équipé d’une
valve d’«Heimlich», chez nous un drain de
«Bülau» (colonne d’eau en pression négative)
est le plus souvent utilisé si un drainage est né-
cessaire. Une aspiration est lentement aug-
mentée par pallier de 5 cm H2O toutes les 30
minutes jusqu’à –20 ou –30 cm de colonne
d’eau. Si aucune bulle d’air n’est aspirée du-
rant 12 heures ou si le poumon s’est redéployé
radiologiquement le drain peut être clampé
brièvement puis durant 6 heures. Si aucune
bulle d’air n’est aspirée après le déclampage du
drain en aspiration, il peut être retiré. Un der-
nier contrôle radiologique doit être effectué
avant la sortie de l’hôpital [13].
Les patients avec un pneumothorax spontané
secondaire doivent être en tous cas hospitalisés
et drainé avec un drain de gros calibre joint à
une colonne de «Bülau».
Fuite d’air persistante
Les avis divergent quant à la marche à suivre
lors de fuite d’air persistante («blublub» sous la
colonne d’eau). Si certains conseillent déjà une
pleurodèse au talc ou une pleurectomie parié-
tale sous vidéo-thoracoscopie pour une fuite
persistante de plus de 48 heures, d’autres at-
tendent 7 jours ou plus tant pour les pneumo-
thorax primaire que pour les pneumothorax se-
condaires dans l’espoir d’un tarissement spon-
tané de la fuite pleurale [14]. Un CT du thorax
est habituellement effectué avant la thoraco-
scopie pour pouvoir localiser d’éventuels
«blebs», qui seront cautérisés durant l’inter-
vention ou excisés par une «wedge-resection».
Prophylaxie des récidives
Un CT du thorax et une sclérose des blebs lors
de l’inspection thoracoscopique suivie d’une
pleurodèse au talc est effectué aujourd’hui dans
beaucoup d’endroits dès la première récidive.
Certains auteurs mettent cependant en garde
contre l’emploi du talc en raison de la descrip-
tion de cas d’insuffisance respiratoire aiguë
après talcage [15]. De telles complications ne
sont pourtant jamais survenues dans ma propre
expérience avec de la poudre de talc. Une alter-
native ou un complément consiste en l’abrasion
mécanique des plèvres. Mais il n’existe presque
aucune étude prospective comparative pouvant
trancher entre les avantages et les inconvé-
nients des différentes méthodes de traitement.
Figure 2.
Drain thoracique, placé dans le 5e
espace intercostal à droite sur la
ligne axillaire antérieure, avec un
drain Charrière 20, placé ventrale-
ment dans la coupole de la cavité
thoracique, réexpansion complète
du poumon droit.

CABINET Forum Med Suisse No9 27 février 2002 205
Ablation des drains thoraciques
On demande au patient d’inspirer de faire une
manœuvre de Valsalva, le drain est ôté pendant
que le patient presse légèrement (Surpression
intra-thoracique) et le lieu d’incision est recou-
vert d’un pansement.
Cas particuliers, complications
Lors d’un collapsus pulmonaire durant depuis
longtemps, il faut veiller à une ré-expansion
lente du poumon avec une aspiration douce afin
d’éviter le risque «d’œdème pulmonaire de ré-
expansion». Les drains thoraciques peuvent
occasionner de fortes douleurs, des infections
pleurales, des hémorragies et une hypotension,
et ils peuvent être mal placés. Des bouchons de
sécrétions bronchiques peuvent empêcher la
ré-expansion du poumon, qui ne devient pos-
sible qu’après une toilette bronchique.
Les patients intubés doivent toujours être drai-
nés avec un drain de gros calibre, car leurs
pneumothorax est souvent dû à des fuites im-
portantes.
Des pneumothorax bilatéraux simultanés sont
rares, et sont dus le plus souvent à des mala-
dies pulmonaires sous-jacentes sévères. Le
traitement est similaire au pneumothorax uni-
latéral, une approche chirurgicale précoce
(pleurectomie) est généralement indiquée [16].
Les patients avec une infection HIV ont sou-
vent une maladie à un stade avancé, p.ex. une
pneumonie nécrosante ou une infection à Pneu-
mocystis-carinii qui provoque le pneumotho-
rax. Le traitement doit tenir compte du pro-
nostic, une instillation d’une substance scléro-
sante par le drain est conseillée même en l’ab-
sence d’évidence de fuite persistante.
Conseils aux patients après
un pneumothorax
Le taux de récidive après un premier épisode
varie entre 16 et 50%. Après un deuxième épi-
sode ce taux est nettement plus élevé que 50%
[17, 18]. La plupart des récidives surviennent
entre 6 mois et 2 ans. Bien qu’il n’existe que
peu de données concluantes, l’arrêt du taba-
gisme devrait avoir une influence bénéfique sur
le taux de récidive. Beaucoup de centres
conseillent une pleurodèse dès la première ré-
cidive. Il faut envisager une pleurodèse dès le
premier épisode chez les pilotes, les plongeurs,
les voyageurs dans les contrées peu équipées.
Comme les patients avec un pneumothorax ont
un risque d’un pneumothorax controlatéral
plus élevé, il faut leur déconseiller, particuliè-
rement chez les patients de moins de 40 ans, la
plongée avec bouteilles durant les 3 premières
années après l’épisode. Les effort physiques
sont à déconseiller durant environ 3 semaines,
le sport et la musiques avec des instruments à
vent sont à déconseiller durant les 2 premiers
mois environ. Ces conseils sont cependant uni-
quement basés sur le bon sens et n’ont pas fait
l’objet d’étude scientifique.
Controverses actuelles
Faire les radiographies en inspiration
ou en expiration?
Des radiographies de Thorax postero-anté-
rieures en expiration souvent sont demandées
lors de suspicion de pneumothorax, mais la su-
périorité des images prises en expiration n’a ja-
mais été prouvée. L’analyse d’une étude portant
sur 85 radiographies pulmonaire en inspiration
et expiration lors de pneumothorax et de 93 ra-
diographies pulmonaire en l’absence de pneu-
mothorax a mis en évidence une sensibilité par-
faitement identique pour les radiographies
prise en inspiration et celles prises en expira-
tion [19]. Comme les radiographies en inspira-
tion sont généralement beaucoup plus infor-
matives, on peu probablement renoncer com-
plètement aux clichés pris en expiration.
Clamper les drains thoraciques?
Faut-il clamper les drains avant de les retirer?
Une enquête de Baumann et Strange [20] a
montré que 67% des centres ont répondu que
le drain devrait être clampé durant 4–24 heures
avant son retrait, 27% attendent 24 heures sans
fuite d’air (absence de bulles sur la colonne
d’eau) avant de retirer le drain (sans clampage
préalable). D’autres, et nous partageons leur
avis, ne voient absolument pas l’utilité de clam-
per un drain lors d’un pneumothorax. Mais si
un drain est clampé, il est important d’instruire
le personnel de lever immédiatement le clam-
page si une dyspnée survient à nouveau (pos-
Tableau 1. Définitions (adapté d’après [23]).
Pneumothorax spontané Pas de trauma préalable, pas d’étiologie iatrogène.
Pneumothorax spontané primaire Pas d’évidence de maladie pulmonaire sous-
jacente connue pour favoriser l’apparition d’un
pneumothorax
Pneumothorax spontané secondaire Présence d’une maladie pulmonaire sous-jacente.
Extension Mesuré de l’apex des poumon jusqu’aux coupoles
diaphragmatiques. La radiographie du thorax prise
debout.
– Petit pneumothorax Moins de 3 cm d’écart avec la paroi thoracique.
– Grand pneumothorax Plus de 3 cm d’écart avec la paroi thoracique
Stabilité clinique
– stable Fréquence respiratoire <24/min. Pouls >60 et
<120/min. TA normale. Saturation d’oxygène à
l’air ambiant >90%. Le patient peut prononcer
des phrases entières sans dyspnée.
– instable Lorsqu’une ou plusieurs des conditions
mentionnées ne sont pas remplies.

CABINET Forum Med Suisse No9 27 février 2002 206
sible récidive de pneumothorax sous tension) et
de surveiller le patient.
Signification des bulles apicales
(«blebs»)?
Cette question aussi est controversée. Certains
auteurs doutent de leur signification dans la pa-
thogénèse des pneumothorax spontanés et dé-
conseillent de les rechercher et d’en faire dé-
pendre l’attitude thérapeutique [21, 22]. Nos
propres expériences montrent cependant qu’il
est avantageux de rechercher les bulles en gé-
néral après une première récidive de pneumo-
thorax et de viser leur excision. Une pleurodèse
peut généralement être effectuée lors de la
même intervention.
Quintessence
Les symptômes cardinaux d’un pneumothorax sont une dyspnée, des
douleurs thoraciques, une toux sèche et un «sensation désagréable»
au niveau du thorax
Les pneumothorax primaires ne sont généralement pas dangereux,
mais un risque est présent lors de pathologies pulmonaires pré-existantes
(pneumothorax secondaire) en raison des réserves cardio-pulmonaires
limitées.
Le pneumothorax sous tension constitue de danger principal, se manife-
stant cliniquement par une tachycardie, une hypotension, une stase jugu-
laire et une percussion hypersonore. Un soulagement immédiat est indiqué
(p.ex. par une aiguille de gros calibre dans le 2eou le 3eespace intercostal
sur la ligne médio-claviculaire.
Les pneumothorax sont habituellement traités avec un drain thoracique.
Les conseils sur le comportement à adopter après un premier épisode et
les mesures prophylactiques, les informations sur le risque de récidive
sont d’une grande importance pour les patients.
1 Melton LJI, Hepper NGG, Offord KP.
Incidence of spontaneous pneu-
mothorax in Olmsted County, Min-
nesota: 1950 to 1974. Am Rev
Respir Dis 1979;120:1379–82.
2 Bense L, Eklund G, Wiman LG.
Smoking and the increased risk of
contracting spontaneous pneu-
mothorax. Chest 1987;92:1009–12.
3 Lesur O, Delorme N, Fromaget JM,
Bernadac P, Polu JM. Computed
tomography in the etiologic assess-
ment of idiopathic spontaneous
pneumothorax. Chest 1990;98:
341–7.
4 Light RW. Pleural Diseases, 3rd ed.
Baltimore: Williams and Wilkins;
1995.
5 Gobbel WG Jr, Rhea WT Jr, Nelson
IA, Daniel RA Jr. Spontaneous
pneumothorax. J Thorac Cardio-
vasc Surg 1963;46:331–45.
6 Ohata M, Suzuki H. Pathogenesis of
spontaneous pneumothorax with
special reference to the ultrastruc-
ture of emphysematous bullae.
Chest 1980;77:771–6.
7 Weissberg D, Refaeli Y. Pneumo-
thorax, Experience with 1,199 Pa-
tients. Chest 2000;117:1279–85.
8 Bense L, Wiman LG, Hedenstierna
G. Onset of symptoms in sponta-
neous pneumothorax: correlations
to physical activity. Eur J Respir Dis
1987;181–6.
9 Harvey JE. Comparison of simple
aspiration with intercostal drain-
age in the management of sponta-
neous pneumothorax. Thorax 1993;
48:430–1.
10 Soulsby T. Thoracic Society guide-
lines for the management of spon-
taneous pneumothorax: do we
comply with them and do they
work? J Accid Emerg Med 1998;
15:317–21.
11 Martin T, Fontana G, Olak J, Fergu-
son M. Use of pleural catheter
for the management of simple
pneumothorax. Chest 1996;110:
1169–72.
12 Minami HSH, Senda K, Horio Y,
Iwahara T, Nomura F, Sakai S, et al.
Small caliber catheter drainage for
spontaneous pneumothorax. Am J
Med Sci 1992;304:345–7.
13 Wyser C, Ullmer E, Bolliger CT.
Pneumothorax. Schweiz Ärztezei-
tung 1998;79:28–31.
14 Schoenenberger RA, Haefeli WE,
Weiss R, Ritz RF. Timing of invasive
procedures in therapy for primary
and secondary spontaneous pneu-
mothorax. Arch Surg 1991;126:
764–6.
15 Campos JR, Werebe EC, Vargas FS,
Jatene FB, Light RW. Respiratory
failure due to insufflated talc.
Lancet 1997;349:251–2.
16 Graf-Deuel E, Knoblauch A. Simul-
taneous bilateral spontaneous
pneumothorax. Chest 1994;105:
1142–6.
17 Lippert HL, Lund O, Blegvad S,
Larsen HV. Independent risk factors
for cumulative recurrence rate after
first spontaneous pneumothorax.
Eur Respir J 1991;4:324–32.
18 Light RW, O’Hara VS, Moritz TE,
McElhinney AJ, Butz R, Haakenson
CM, et al. Intrapleural tetracycline
for the prevention of recurrent
spontaneous pneumothorax: re-
sults of a Department of Veterans
Affairs cooperative study. JAMA
1990;264:2224–30.
19 Seow A, Kazerooni EA, Pernicano
PG, Neary M. Comparison of up-
right inspiratory and expiratory
chest radiographs for detecting
pneumothoraces. Am J Roentgenol
1997;168:842–3.
20 Baumann MH, Strange C. The
clinician’s perspective on pneumo-
thorax management. Chest 1997;
112:822–8.
21 Mitlehner W, Friedrich M, Diss-
mann W. Value of computer tomog-
raphy in the detection of bullae and
blebs in patients with primary
spontaneous pneumothorax. Respi-
ration 1992;59:221–7.
22 Smit HJ, Wienk MA, Schreurs AJ,
Schramel FM, Postmus PE. Do bul-
lae indicate a predisposition to re-
current pneumothorax? Br J Radiol
2000;73:356–9.
23 Baumann MH, Strange C, Heffner
JE, Baumann MH, Light R, Kirby
RJ, et al. Management of sponta-
neous pneumothorax. An American
College of Chest Physicians Delphi
consensus statement. Chest 2000;
119:590–602.
Références
1
/
5
100%