Prise en charge des effets secondaires des thérapeutiques ciblées

Prise en charge
des effets secondaires
des thérapeutiques ciblées
(hors dermatologiques)
Management of non-dermatologic
adverse events of targeted biotherapies
Olivier Bouché, Elodie Scaglia,
Stéphanie Lagarde
Service d’hépatogastroentérologie
et cancérologie digestive,
hôpital Robert-Debré,
CHU de Reims,
avenue du Général-Koenig,
51092 Reims cedex, France
e-mail : <[email protected]>
Résumé
Les limites des chimiothérapies anticancéreuses ont réorienté les recher-
ches vers des biothérapies dites « ciblées », visant l’angiogenèse et la proli-
fération cellulaire initiée par des récepteurs tyrosines-kinases aux facteurs
de croissance. Bien que l’action des biothérapies soit plus ciblée que les
chimiothérapies, de nouveaux effets secondaires, différents des effets
iatrogènes classiques, ont été décrits et nécessitent une prise en charge spé-
cifique. Ces effets, même mineurs, peuvent retentir sur la qualité de vie des
pattients, provoquer une moindre observance du traitement et imposer
des reports, voire des arrêts thérapeutiques délétères. Une hypomagnésé-
mie et une hypocalcémie doivent être recherchées avant chaque cure
d’anti-EGFR (cetuximab, panitumumab) avec supplémentation intravei-
neuse adaptée si nécessaire. Une prémédication intraveineuse par antihis-
taminique H1 et corticoïdes ainsi que la présence à proximité d’un médecin
et d’un matériel de réanimation sont recommandées lors de l’administra-
tion du cetuximab compte tenu du risque exceptionnel d’allergie grave.
L’hypertension artérielle (HTA) et la protéinurie sont des effets de la classe
des antiangiogéniques (bevacizumab, sorafenib, sunitinib). La mesure de la
pression artérielle (PA) doit être ambulatoire. La prise en charge diagnos-
tique et thérapeutique de l’HTA doit s’effectuer conformément aux recom-
mandations de la HAS. Pour le bevacizumab, un délai de quatre semaines
avant et après une chirurgie majeure doit être respecté et la cicatrisation
des plaies doit être vérifiée. Le patient doit être informé des risques excep-
tionnels de complications graves : thromboses artérielles, perforation
digestive, hémorragie. Les effets secondaires de l’imatinib sont fréquents,
mais souvent non sévères et transitoires, à type d’œdèmes, de troubles
digestifs, d’arthralgies, de myalgies, de crampes, d’éruptions cutanées. Un
traitement adapté précoce de ces symptômes doit être prescrit pour amé-
liorer la compliance à l’imatinib. Une surveillance de la fonction cardiaque
est nécessaire sous trastuzumab. La collaboration interdisciplinaire entre le
médecin prescripteur et ses confrères généralistes et spécialistes doit être
étroite pour optimiser la prise en charge.
nMots clés : thérapie ciblée, iatrogénie, thérapeutique, anti-EGFR, médicament
antiangiogénique, hypertension, protéinurie, imatinib, cancer
Abstract
The limits of the antineoplasic chemotherapies reoriented the research
to “targeted”biotherapies, aiming the angiogenesis and the cellular
HEPATO
n
GASTRO
et Oncologie digestive
15
HEPATO-GASTRO et Oncologie digestive
Mini-revue
doi: 10.1684/hpg.2009.0368
vol. 17 n° spécial, avril 2010
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

proliferation initiated by tyrosine-kinase receptors to growth factors.
Although the action of the biotherapies is more targeted than chemothe-
rapies, new adverse staleness, different from the classic iatrogenic effects
of chemotherapies, have been described and require a specific manage-
ment. These effects, even minor, can impact the patient’s quality of life,
provoke a least observance of the treatment, and even impose deleterious
delays or therapeutic stops. A hypomagnesemia and a hypocalcemia must
be checked before every administration of anti-EGFR (cetuximab, panitu-
mumab) with parenteral supplementation adapted. An intravenous pre-
medication by antihistaminic H1 and corticosteroids, as well as the close
presence of a physician and resuscitation equipment, are recommended
during the administration of cetuximab, considering the exceptional risk
of serious allergy. The arterial hypertension (AHT) and the proteinuria are
effects of the angiogenesis inhibitors class (bevacizumab, sorafenib, suniti-
nib). The measure of the arterial pressure must be ambulatory. The diag-
nostic and therapeutic managements of AHT must be done in accordance
with national or international guidelines. For the bevacizumab, a delay of
four weeks before and after a major surgery must be respected and the
wound healing must be verified. The patient must be informed of excep-
tional risks of serious complications: arterial thromboembolic events, diges-
tive perforation, hemorrhage. The toxicities of imatinib are frequent, but
often stern and transient, such as oedema, digestive unrests, arthralgia,
myalgia, muscle cramps, and cutaneous rash. An early adapted treatment
of these symptoms must be prescribed to improve the compliance with
imatinib. Cardiac function follow-up is required with trastuzumab. The
multidisciplinary collaboration between the physician prescriber and his/
her/its colleagues general and specialists practitioners must be narrow to
optimize cares.
nKey words: targeted therapies, side-effects, treatments, safety, EGFR inhibitor,
angiogenesis inhibitor, hypertension, proteinuria, imatinib, cancer
L’efficacité de biothérapies ciblant EGFR (cetuximab et
panitumumab pour les cancers colorectaux métasta-
tiques [CCRM], erlotinib pour les cancers pancréatiques
métastatiques), l’angiogenèse (bevacizumab, sunitinib et
sorafenib pour les CCRM, les GIST et les carcinomes hépa-
tocellulaires respectivement) [1], KIT (imatinib pour les
GIST), mTOR (everolimus pour les tumeurs endocrines
bien différenciées) et HER2 (trastuzumab pour les cancers
gastriques) a validé le concept d’inhibition ciblée en cancé-
rologie digestive. Le clinicien se doit de connaître, prévenir
et traiter les toxicités « nouvelles » de ces thérapies ciblées
auxquelles il n’était pas confronté avec les chimiothérapies
anticancéreuses classiques [2, 3].
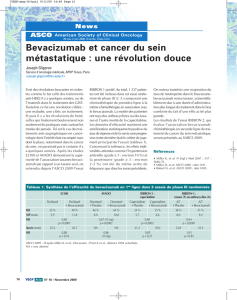
Prérequis à la prescription
La lecture des résumés des caractéristiques des produits est
un préalable nécessaire avant leur utilisation. Des revues
récentes ont rappelé les prérequis d’information, d’éduca-
tion, de prévention et de surveillance [1, 3, 4]. Les données
spécifiques principales sont résumées dans la figure 1.
La remise de documents d’information ou de carnets de
liaison est conseillée, notamment pour les biothérapies
orales (erlotinib, sorafenib, sunitinib, imatinib, everolimus).
Prise en charge des effets secondaires
des inhibiteurs de EGFR
Lésions cutanées
Les effets secondaires cutanés sont les plus fréquents [3] :
folliculite aseptique acnéiforme, xérose, paronychies,
hyperpigmentation et anomalies des phanères (cf. chapitre
infra).
Abréviations
Cancers colo-rectaux métastatiques (CCRM)
Hypertension artérielle (HTA)
Recommandations de Pratiques Cliniques (RPC)
Pression artérielle (PA)
Bandelette urinaire (BU)
Fraction d’éjection ventriculaire gauche (FEVG)
16 HEPATO-GASTRO et Oncologie digestive
vol. 17 n° spécial, avril 2010
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Figure 1. Contre-indications, prérequis et surveillance de la prescription des biothérapies ciblées (d’après Bouché et al. [3, 4]).
17
HEPATO-GASTRO et Oncologie digestive
Mini-revue
vol. 17 n° spécial, avril 2010
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Réactions à la perfusion
Des réactions précoces à la perfusion du cetuximab et plus
exceptionnellement à celle de l’anticorps humain panitu-
mumab, sont possibles, le plus souvent lors de la première
injection. Elles peuvent aller jusqu’au choc anaphylactique
pour le cetuximab. Une prémédication intraveineuse par
antihistaminique H1, et surtout par corticoïdes [5], ainsi
que la présence à proximité d’un médecin et d’un matériel
de réanimation sont recommandées lors de l’administra-
tion du cetuximab, à chaque cycle. En revanche, la prémé-
dication et la proximité du matériel de réanimation ne sont
pas nécessaires pour le panitumumab. La survenue d’un
bronchospasme, d’un œdème laryngé et/ou d’un choc ana-
phylactique doit faire arrêter et débrancher immédiatement
la perfusion et mettre en œuvre en urgence le traitement
médical symptomatique. Le cetuximab est dans ce cas défi-
nitivement contre-indiqué avec possibilité d’un relais par le
panitumumab [6].
Asthénie, crampe et hypomagnésémie
Une hypomagnésémie et une hypocalcémie (par fuite
rénale) doivent être recherchées avant chaque cure, puis
régulièrement après l’arrêt des anti-EGFR. Les hypomagné-
sémies sévères peuvent être symptomatiques avec des
complications neurologiques ou cardiaques. Une supplé-
mentation parentérale adaptée (4 g de sulfate de magné-
sium i.v. en deux heures à chaque cure) est recommandée
dès que la magnésémie est inférieure à 1,2 mg/dL [7]. En
cas d’hypomagnésémie sévère (inférieure à 0,9 mg/dL), un
arrêt temporaire de l’anti-EGFR et une supplémentation
(8 g i.v. en quatre heures par jour jusqu’à normalisation)
sont conseillés. L’apport oral de magnésium est générale-
ment inefficace et mal toléré [7].
Lésions oculaires et des muqueuses
Des lésions de type xérophtalmie, blépharite, conjonctivite
et exceptionnellement kératite et ulcération de cornée sont
possibles. Les lésions oculaires peuvent être favorisées par
la trichomégalie, notamment s’il existe un trichiasis. Le trai-
tement comprend la taille des cils, des larmes artificielles,
des collyres antibiotiques ou corticoïdes après avis ophtal-
mologique [3]. Des lésions muqueuses non spécifiques à
type de chéilite, de glossite, voire d’ulcérations buccales,
nasales ou génitales ont également été observées. Les trai-
tements symptomatiques locaux des lésions muqueuses
n’ont pas de spécificité : antiseptiques, lubrifiants [3].
Troubles digestifs et respiratoires
La diarrhée semble plus fréquente avec l’erlotinib (50 %)
qu’avec les anticorps cetuximab et panitumumab. Des per-
forations digestives ont été rapportées sous erlotinib.
Le traitement symptomatique des troubles digestifs n’a
pas de spécificité [3]. Si les patients se plaignent de dyspnée
ou de toux, il est recommandé de rechercher une pneumo-
pathie interstitielle [3].
Prise en charge des effets secondaires
du bevacizumab
Hypertension artérielle et protéinurie
Dans les essais thérapeutiques, la prise en charge de
l’hypertension artérielle (HTA) n’a pas tenu compte des
recommandations internationales de diagnostic et de trai-
tement de l’HTA. Il existe un double risque de sous-
estimation et de surestimation de l’HTA [3]. C’est pourquoi,
sous l’égide de plusieurs sociétés savantes françaises, un
groupe de travail d’hypertensiologues, de néphrologues,
de cardiologues et d’oncologues a élaboré des recomman-
dations de pratiques cliniques (RPC) concernant la prise en
charge des effets vasculaires et rénaux des antiangiogéni-
ques [8]. Les objectifs seront d’éviter, d’une part, un arrêt
inapproprié du bevacizumab et, d’autre part, une compli-
cation grave de l’HTA.
Les RPC sont les suivantes [8] :
–la première administration ne doit pas être retardée
en raison d’une pression artérielle (PA) élevée ou d’une
protéinurie (hors urgence hypertensive et protéinurie
massive) ;
–la mesure de la PA doit au mieux être réalisée en ambu-
latoire par le médecin traitant et/ou par automesures à
domicile par un appareil validé par l’AFSSAPS. Le « schéma
des 3 » édicté par la HAS est conseillé [9] : trois prises de
la PA le matin au réveil et le soir au coucher, à cinq minu-
tes d’intervalle, trois jours de suite ;
–un traitement de l’HTA doit être débuté si la PA est
supérieure à 135 et/ou 85 mmHg en ambulatoire ;
–bandelette urinaire (BU) [et le cas échéant, quantifica-
tion de la protéinurie], estimation de la fonction rénale
(formule de MDRD simplifiée plutôt que Cockcroft et
Gault) doivent être faites avant traitement et au cours
du suivi (avis néphrologique si clairance est inférieure à
30 mL/min) ;
–la prise en charge se fera au mieux dans le cadre d’un
travail en réseau comprenant médecin généraliste, onco-
logue, cardiologue et néphrologue avec carnet de suivi.
Seule une « urgence hypertensive » (encéphalopathie, HTA
maligne, insuffisance cardiaque, dissection aortique, acci-
dents artériels ou leucoencéphalopathie postérieure) néces-
site un arrêt définitif du traitement. La conduite à tenir est
résumée dans la figure 2 [8]. En l’absence de protéinurie, les
antihypertenseurs classiques peuvent être utilisés : IEC,
ARA2, inhibiteurs calciques, bêtabloquants et diurétiques
[8]. Des exemples d’ordonnances sont disponibles dans le
Thésaurus national de cancérologie digestive [10].
18 HEPATO-GASTRO et Oncologie digestive
vol. 17 n° spécial, avril 2010
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Uneprotéinurieà++ou+++àlaBUestuneindica-
tionàlamesuredelaprotéinuriesur24heures(ou
échantillon matinal) et de la créatininémie durant
l’intercure (figure 3). Le bevacizumab peut être prescrit
jusqu’au seuil de protéinurie inférieur à 3 g par
24 heures, sous réserve d’un avis néphrologique [8].
Dès le seuil supérieur à 1 g par 24 heures, l’utilisation
d’un antihypertenseur de la classe des IEC ou des
ARA2 est conseillée, compte tenu de leur effet
antiprotéinurique [8].
Perforations gastro-intestinales
La perforation gastro-intestinale est une complication rare
(2 %) qui justifie un examen clinique chez tout patient se
plaignant de douleurs abdominales [11]. Elle est habituel-
lement précoce (trois premiers mois). Elle survient le plus
souvent sur une muqueuse inflammatoire : diverticulite,
colite, ulcère gastro-intestinal, tumeur en place, carcinose
péritonéale [11]. Sa prise en charge doit être si possible
conservatrice, avec aspiration nasogastrique sans chirur-
gie [11]. La présence d’une tumeur en place ne contre-
indique pas le bevacizumab, car le risque de perforation
reste faible.
Hémorragies
Diverses manifestations hémorragiques cutanéomuqueuses
sans gravité peuvent survenir, à type d’épistaxis, de gingi-
vorragies ou de saignements vaginaux [1, 3]. La prise d’anti-
coagulants nécessite une surveillance rigoureuse du bilan de
coagulation. Les hémorragies tumorales graves sont rares
(5 %) mais potentiellement responsables de décès, notam-
ment en cas d’hémoptysie massive ou d’hémorragies intra-
cérébrales.
Complications de la cicatrisation des plaies
Il convient de respecter un délai de 28 jours entre une chi-
rurgie majeure et le début du traitement par bevacizumab
et d’interrompre, à l’inverse, le traitement pendant une
durée de quatre à cinq semaines avant une chirurgie
programmée [1, 3, 10]. En pratique, la dernière cure de
Situation
PA ambulatoire (MG ou AMT) systématiquement
à S1, S2, S4 puis chaque mois
PA normale ou
HTA contrôlée
Urgence
hypertensive
PA non contrôlée* chez un patient
asymptomatique
PA non contrôlée* chez un
patient symptomatique
1 fois par mois ou plus fréquent
tant que la PA n'est pas contrôlée
1 fois par semaine tant que
l'HTA est symptomatique
;
obtention d'un contrôle PA
adéquat indespensable
Traitement anti-HTA adapté au
niveau de PA et évolutivité
;
monothérapie initiale si PA
modérement élevée,bithérapie
d'emblée si + sévère
; continuer AA
Traitement antiHTA
institué
; bithérapie d'emblée
le + souvent
; intensification
rapide du traitement
;
continuer AA
Traitement antiHTA initial
: en l'absence de protéinurie
: choisir
parmi 1 des 5 grandes classes d'antihypertenseurs
;
si protéinurie
: IEC ou ARA2 en 1re intention.
PA
: 1 fois/mois
(MG ou AMT)
*PA non contrôlée
: > 135 et/ou 85 mmHg (PA en AMT) ou ≥ 140 et/ou 90 mmHg (PA de consultation)
MG
: médecin généraliste
AMT
: auto-mesure tensionnelle
AA
: anti-angiogéniques
S1, S2, S4
: semaine 1, 2 et 4
Pas de
modification
thérapeutique
;
continuer AA
Hospitalisation
;
prise en charge de
l'urgence
;
arrêt des AA
Surveillance
Conduite à tenir
Traitement antihypertenseur
Figure 2. Prise en charge de la pression artérielle (PA) au cours du suivi (d’après Halimi et al. et Thésaurus national de cancérolo-
gie digestive [8, 10]).
19
HEPATO-GASTRO et Oncologie digestive
Mini-revue
vol. 17 n° spécial, avril 2010
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%