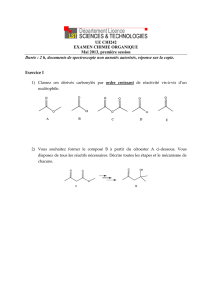
3) Comment représenter les molécules

1) Le monde de la chimie organique, notre monde ?
C’est la chimie du carbone et de ses composés : du
méthane CH4 à l’ADN !
Quelques exemples :
La nourriture : sucres, lipides, protéines, acides
nucléniques…
La santé : médicaments, savons, parfums…
L’environnement : vêtements, polymères, bois,
plastiques, peintures …
Chimie organique
Structure, liaisons et nomenclature
1

Certaines molécules sont synthétisées dans la
nature, d’autres sont issues d’une transformation
dirigée par la main de l’homme.
Mais ces transformations utilisent des produits
dangereux,qui parfois provoquent des pollutions, des
dommages, des maladies.
1) Le monde de la chimie organique, notre monde ?
2

En chimie organique, les molécules
constituent le vocabulaire tandis que les
mécanismes réactionnels correspondent à
la grammaire.
Les groupes fonctionnels conditionnent
la réactivité des molécules organiques.
2) Un peu d’histoire :
3

La liaison covalente
La règle en chimie organique est de
respecter la tétravalence du carbone ainsi
que la valence des autres atomes
combinés pour former la molécule.
3) Comment représenter les molécules ?
4
Les atomes sont réunis par des liaisons
simples, doubles ou triples.

La liaison covalente
3) Comment représenter les molécules ?
5
On utilisera souvent la représentation
semi-développée qui fait apparaître
clairement les deux éléments essentiels
de la molécule :
squelette carboné
et groupements fonctionnels.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%