Measurement of Air Trapping, Intrinsic Positive End

Measurement of Air Trapping, Intrinsic Positive End-
Expiratory Pressure, and Dynamic Hyperinflation
in Mechanically Ventilated Patients
Lluý´s Blanch MD PhD, Francesca Bernabe´ MD, and Umberto
Lucangelo MD
P.BEFORT (Montpellier)
DESC réa med.
décembre 2006

Introduction
•Les décompensations respiratoires des patients BPCO sont une cause
fréquente d’admission en réanimation.
•Patient avec une obstruction des voies aériennes (bronchospasme,
inflammation, secrétions) présente un trapping des volumes
pulmonaires en fin d’expiration et une augmentation des
efforts expiratoires afin d’augmenter la pression alvéolaire, ceci
sans gain sur le flux expiratoire.
La ventilation alvéolaire est préservée au coût d’une augmentation du
travail respiratoire.
On assiste à une diminution de la compliance du système respiratoire et à
un travail musculaire défavorable de par un étirement
excessif des fibres musculaires secondaires à la distension
pulmonaire. Augmentation du risque d’arrêt respiratoire.
(Schmidt et al. Acute or chronic respiratory failure: assessement and management of
patients with COPD in the emergency setting. JAMA 1989;261:3444-3453)

Patients concernés
•BPCO
•Asthmatiques
•(SDRA)

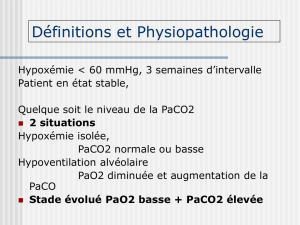
Qu’est ce que hyperinflation dynamique ?
• Chez le patient qui présente une obstruction, l’expiration pulmonaire
est ralentie. Elle est interrompue précocement par l’effort inspiratoire
suivant avec pour conséquence un « trapping » gazeux.
•Le volume en fin expiration est supérieure à la
capacité fonctionnelle résiduelle théorique.
•Hyperinflation dynamique = auto-PEEP.
•Est influencée par le Vt, le temps expiratoire, la résistance et la
compliance pulmonaire
•Décrit initialement par Bergman en 1972 et Jonson en 1975.
•(Bergman NA. Intrapulmonary gas trapping during mechanical ventilation at rapid
frequencies. Anesthesioloy 1972;37:626-633.
•Jonson B et al. Monitoring of ventilation and lung mechanics during automatic
ventilation: a new device. Bull Physiopathol Respir 1975;11:729-743.)

 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%