l, ..., l

Le modèle
atomique
1

Les points essentiels
Le spectre de l’hydrogène (section 9.4)
L’évolution du modèle atomique (section 9.5)
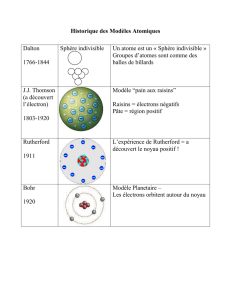
•Le modèle de Thomson
•Le modèle de Rutherford
Le modèle atomique de Bohr (section 9.6)
Le modèle quantique
2

Le spectre de raies
Fin du 19ième Chaque élément est caractérisé par un
ensemble de raies qui permettent de l’identifier – Mais
Pourquoi ?
1885 –Mathématicien suisse Johann Balmer
HaHbHgHd
656.3 486.1 434.1 410.2 l(nm)
Spectre de l’hydrogène
3

Formule empirique de Balmer
l
m 364,56 m2
m2 - 4
(m 3, 4, 5 et 6)
Formule de Rydberg-Ritz
(alcalins Li, Na, K, et Cs)
1
l
R Z2 1
n2
21
n1
2
(n1n2)
(R= 1,09737 x 107m-1)4

Quelques propriétés atomiques
1) Les atomes sont de dimensions microscopiques,
~ 10-10 m. La lumière visible ne peur résoudre la
structure (l quelques centaines de nm.
2) Les atomes sont stables
3) Les atomes contiennent des charges négatives,
des électrons, mais sont électriquement neutres.
Un atome avec Zélectrons doit aussi posséder le
même nombre de protons (+Ze).
4) Les atomes émettent et absorbent des
radiations EM (il y a interaction atome lumière)
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%