Tp X - LA SYNTHESE ORGANIQUE D`UN MEDICAMENT

Lycée Michel de Montaigne - M. Brasseur - Année 2012 / 2013
Tp
- LA SYNTHESE ORGANIQUE D'UN MEDICAMENT
CORRECTION
4.1. Concernant la synthèse.
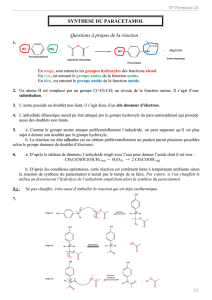
1. L'anhydride éthanoïque est liquide car sa température de fusion est inférieure à 20°C et sa empérature d'ébullition supérieure à 20 °C.
Le paraminophénol est solide car sa température de fusion est supérieure à 20°C.
2. Lors de cette synthèse, il faut se protéger avec des gants, des lunettes, une blouse et manipuler sous une hotte aspirante.
3. Des deux schémas, le montage n°1 est le montage à reflux: il permet d'accélérer une réaction par chauffage sans perte de matière.
Le second montage est de distillation: il permet par chauffage, de spérarer les constituants d'un mélange.
4. Voir ci-contre
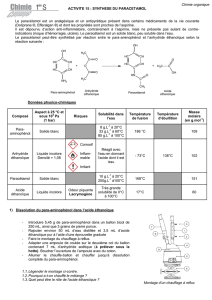
5. On chauffe le mélange car la solubilité du 4 aminophénol augmente
avec la température
6. L'acide éthanoïque joue le rôle de solvant. Le solvant "habituel" est
l'eau. Mais d'après les données du document 2 :
le paraminophénol est très peu soluble dans l'eau par contre très
soluble dans un milieu organique;
l'anhydride éthanoïque réagit avec l'eau.
A 60°C, la solubilité du 4-aminophénol dans l'eau est de 33 g/L. Donc
pour dissoudre les 3 g de 4 aminophénol, il aurait fallu 100 mL d'eau.
Nous n'utilisons que 25 mL d'acide éthanoïque.
7. A l'issue de la synthèse, on trouvera le paracétamol et l'acide
éthanoïque (+) le réactif en excès.
Les espèces solides à température ambiante sont uniquement le
paraminophénol (si c'est le réactif en excès) et le paracétamol car leurs
températures de fusion sont supérieures à 20°C.
Remarque. On montrera par le calcul (voir question 23) que le réactif limitant
est le paraminophénol donc au final la seule espèce solide est le paracé-
tamol.
8. La technique de recristallisation est fondée sur la différence de solubilité
du paracétamol à chaud et à froid. De façon générale, pour cette technique,
on choisit un solvant dans lequel le solide est soluble à chaud et peu
soluble à froid. On ajoute le minimum de solvant. La recristallisation doit
être assez lente. Elle est amorcée par le choc thermique ou en faisant crisser
une baguette de verre contre la paroi.
On rince à l'eau froide car le paracétamol est peu soluble dans l'eau
Potence
Réfrigérant
Ballon
Mélange réactionnel
Chauffe ballon
Plateau élévateur
Arrivée
d'eau
Sortie
d'eau
4.2. Concernant la filtration.
9. Voir ci-contre
10. Par aspiration, la filtration sur büchner par rapport à une filtration simple permet
d'accélerer la filtration et aussi d'éviter l'obstruction des trous du papier filtre.
11. On redissout le produit de la filtration dans de l'eau que l'on porte à ébullitio puis on
laisse refroidir et on rajoute de l'eau glacée et on effectue une recristallisation et une filtra-
tion.
L'acide éthanoïque présent dans le mélange est très peu soluble dans l'eau. Un minimum
d'eau est à utiliser afin de solubiliser le minimum de paracétamol dans les eaux de rinçage,
et de l'eau glacée pour abaisser encore la limite de solubilté.
4.3. Concernant la CCM.
12. On observe 2 tâches au-dessus du dépôt S de la solution de synthèse: c'est un mé-
lange.
Aucune tâche au-dessus du dépôt S de la solution de synthèse à la même hauteur que la
tâche du dépôt A de la solution de paraminophénol: le réactif A a donc été consommé.
Une tâche au-dessus du dépôt S de la solution de synthèse à la même hauteur que la tâche
du dépôt D de la solution du médicament de Doliprane: la solution S contient bien du Para-
cétamol.
13. On aurait pu utiliser le banc Koffler
A Solution de paraminophénol
S Solution de synthèse du médicament
D Solution du médicament Doliprane
A S D

Lycée Michel de Montaigne - M. Brasseur - Année 2012 / 2013
5. Questions à propos de la réaction.
14. Groupe
amino
Groupe
hydroxyle
Groupe
amide
16. D'après le document 4:
L'anhydride éthanoïque est un réactif qui réagit avec le groupe amino présent sur une molécule.
15. Lors de cette transformation chimique, seul un groupe caractéristique amino du réactif principal (paraminophénol) est modifié: il
est remplacé par un groupe amide: il s'agit d'une réaction de substitution.
L'anhydride éthanoïque est un réactif qui réagit avec le groupe hydroxyle présent sur une molécule.
A la lumière de ces données et dans le cas de la réaction entre l'anhydride éthanoïque et la paraaminophénol, on peut facilement
prévoir l'obtention de deux composés suivants:
Synthèse voulu
Synthèse non voulu

Lycée Michel de Montaigne - M. Brasseur - Année 2012 / 2013
17 & 18. L'azote du paraaminophénol est donneur d'électrons.
Se pose alors la problématique suivante: Comment expliquer la synthèse du paracétamol, puisque cette synthèse possède un réactif
(le paraaminophénol) ayant deux fonctions qui peuvent réagir avec l'anhydride éthanoïque.
Il faut alors comprendre les termes suivants:
si une réaction de chimie organique donne exclusivement ou préférentiellement un produit parmi tous les produits
réactionnels imaginables "sur le papier", on qualifie la réaction de sélective;
s'il subsiste un choix entre -NH2 et -OH, l'anhydride réagit avec le groupe amino -NH2 car il est meilleur nucléophile
(site donneur d'un doublet d'électrons) que -OH. Ainsi, l'anhydride éthanoïque, qui peut réagir avec les deux groupements,
"sélectionne" le groupe avec lequel il va réagir: il est chimiosélectif !
Remarque. Il existe donc un "classement" des sites nucléophiles .....
Ainsi on peut avoir le classement suivant: - NH2 >- OH > - COOH avec > signifie "meilleur nucléophile que "
Par exemple:
la molécule d'acide salicylique présente les groupes - OH et - COOH. En présence d'anhydride éthanoïque c'est le groupe
- OH qui sera le site donneur d'électrons
la molécule de para-aminophénol présente les groupes - NH2 et - OH. En présence d'anhydride éthanoïque c'est le groupe
- NH2 ( et pas - OH comme dans l'acide salicylique) qui sera le site donneur d'électrons

Lycée Michel de Montaigne - M. Brasseur - Année 2012 / 2013
6. Pour aller plus loin.
21. Le paracétamol (contraction de para-acétyl-amino-phénol) est la substance active de nombreuses spécialités médicamenteuses
de la classe des antalgiques antipyrétiques. Il est indiqué dans le traitement symptomatique de la fièvre et des douleurs d'intensité
faible à modérée, seul ou en association à d'autres analgésiques. Contrairement à l'aspirine, il est dépourvu de propriétés anti-in-
flammatoires et n'agit pas sur l'agrégation plaquettaire.
Les analgésiques sont des médicaments utilisés en médecine dans le but d’éliminer la douleur d’un patient (les antalgiques ne
faisant qu’atténuer la douleur).
Les antipyrétiques sont des médicaments dont le rôle est de combattre la fièvre.
Un anti-inflammatoire est un médicament destiné à combattre une inflammation.
Le principal inconvénient est sa toxicité gastrique : il peut en effet engendrer des douleurs accompagnées de nausées voire de
vomissements, en raison de son pH acide qui peut aboutir au développement d’ulcères gastriques.
22. A partir de la molécule de para-aminophénol, écrire la formule semi-développée du phénol.
23.
24.
19.
Remarque. Pourquoi utiliser un anhydride éthanoïque et par l'acide éthanoïque correspondant ?
L'acylation directe de la fonction amine du paraminophénol par l'acide éthanoïque est difficile à réaliser. En efft, la réaction acide-base
entre l'acide carboxylique et l'amine conduit à la formation du carboxylate d'ammonium. Ainsi disparaissent à la fois le caractère
nucléophile de l'amine et le caractère d"jà faiblement électrophile de l'acide
1
/
4
100%