1 Chapitre 1 : Structure et liaisons 1.1.La structure des atomes 1.2

Chapitre 1
Geoffroy Kaisin Résumé de chimie organique
1
Chapitre 1 : Structure et liaisons
1.1.La structure des atomes
1.2.La structures des atomes : les orbitales. 3-5
Plus on s’éloigne du noyau, plus les couches sont instables (les e- ont donc de plus en
plus d’énergie).
Dans ce cours :seulement 3 des 5 orbitales sont abordées : S,P et D :
Convention : chaque orbitale à un lobe + et un lobe -.
1.3. La structure des atomes : Configurations électroniques. 5-6
3 grands principes :
1.Principe « Aufbau » : On place d’abord les électrons dans les orbitales les plus
stables.
2.Principe d’exclusion de Pauli : On ne peux placer que deux électrons au maximum
sur chaque orbitales (avec leur spin en position antiparallèle).
3.Règle de Hund : Quand 2 (ou plus) orbitales vides d’énergie égale sont disponible,
chaque électron occupe une orbitale jusqu’à ce que toute ces orbitales soit occupée (les
électrons ont leurs spins parallèles)
(on fait donc une première tournée pour rassasier tout le monde, et ensuite on
redistribue les restes :D)
Etat fondamental du C : 1s²2s²2p² Etat excité : 1s²2s12p³
1.4. Développement de la théorie de la liaison chimique. 6-7
Le carbone est tétravalent => possibilité de créer 4 liaisons.
1.5.Nature de la liaison chimique : Les liaisons ioniques. 7-9
Les atomes se lient entre eux afin d’atteindre un niveau d’énergie plus bas : ils
cherchent à avoir la structure de l’octet qui est très stable (celle des gazs rares).
Liaison ionique : liaison entre un élément électronégatif (droite du tableau) et un
élément électropositif (élément de la gauche du tableau).
1.6. Nature de la liaison chimique : Les liaisons covalentes.
Liaisons covalentes = mise en commun d’électron.

Chapitre 1
Geoffroy Kaisin Résumé de chimie organique
2
1.7.Formation des liaisons covalentes : Théorie des orbitales moléculaires.
2 types de MO (Orbitale Moléculaire) : liaison σ et liaison π.
Principe de Pauling (ou du recouvrement orbitalaire maximum) : Les MO σ sont plus
stable que les MO π.
1.8.Hybridation : orbitale sp³ et la structure du méthane.
Hybridation de 3 orbitales p et de l’orbitale 2S, peux donner lieu a 4 liaison σ. Forme
tétraédrique.
1.9.Structure de l’éthane.
1.10. Hybridation : orbitale sp² et la structure de l’éthylène. 23-24
Hybridation de 2 orbitale P et de l’orbitale 2S, peux donner lieu a 3 liaisons σ et une
liaison π. Forme plane. Donne lieu à une liaisons doubles.
1.11.Hybridation : orbitales sp et structure de l’acétylène. 25-26
Hybridation de 1 orbitale p et de l’orbitale 2s, peux donner lieu à 2 liaisons σ et deux
liaisons π. Forme linéaire. Donne lieu à une liaison triple ou deux liaisons doubles.
1.12.Hybridation d’autres atomes. 27-28
Azote :

Chapitre 1
Geoffroy Kaisin Résumé de chimie organique
3
Oxygène :
Cas du bore et de l’aluminium.
Bore :
Ces atomes vont avoir 3 orbitales hybride sp² et une orbitale p vacantes. Forme plane.
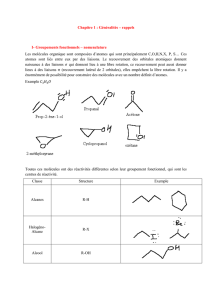
Remarque : « Il y a formule et formule. » 32
Formule empirique : formule la plus simple possible. Elle donne uniquement les rapport
stoechiométrique entre les différents atomes qui composent cette substance.
Formule moléculaire : Elle donne le nombre réel d’atome dans la molécule. Elle est égal ou
un multiple entier de la formule empirique.
Formule moléculaire développée plane : indique dans le plan l’enchaînement et le mode de
liaisons des différents atomes composant une molécule de la substance.
Formule moléculaire semi développée : indique dans le plan l’enchaînement des différentes
fonctions d’une des molécules de la substance.
1
/
3
100%