sem 6

SPE PC* - CHIMIE SEMAINE 6 17/10 – 04/11
Les capacités exigibles du programme sont en italique.
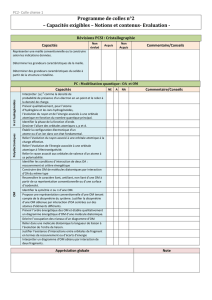
Orbitales moléculaires
Méthode CLOA.
Interaction de deux orbitales atomiques sur deux centres : recouvrement ; orbitales liante, antiliante, non liante ;
énergie d’une orbitale moléculaire ; orbitale σ, orbitale π ; représentation conventionnelle d’une orbitale
moléculaire par schématisation graphique de la combinaison linéaire des orbitales atomiques.
Identifier les conditions d’interaction de deux orbitales atomiques : recouvrement et critère énergétique.
Construire les OM de molécules diatomiques par interaction d’orbitales atomiques du même type (s-s, pp).
Reconnaître le caractère liant, antiliant, non liant d’une OM, la symétrie
ou π à partir de sa représentation
conventionnelle ou d’une surface d’iso-densité. Ex : H2, O2.
Proposer une représentation conventionnelle d’une orbitale moléculaire tenant compte d’une éventuelle
dissymétrie du système. Justifier la dissymétrie d’une orbitale moléculaire obtenue par interaction d’orbitales
atomiques centrées sur des atomes d’éléments différents. Ex : HF simplifié.
Ordre de liaison dans les molécules diatomiques.
Relier dans une molécule diatomique l’évolution de la longueur et de la constante de force de la liaison à l’évolution
de l’ordre de liaison.
Propriétés magnétiques (dia-para).
Interaction d'orbitales de fragments (on se limite à des cas très simples, H2, H3 plan ou H4 carré, ou on donne les
orbitales de fragments). Ex de BeH2.
Justifier l’existence d’interactions entre orbitales de fragment en termes de recouvrement ou d’écarts d’énergie
(ex de l'éthylène limité aux OM de plus basse énergie et aux interactions entre orbitales de fragments identiques)
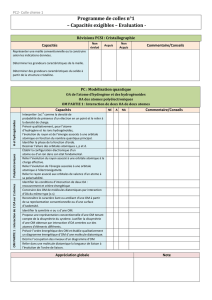
Orbitales moléculaires et réactivité
Approximation des orbitales frontières :
Utiliser les OF pour prévoir la réactivité nucléophile ou électrophile d'une entité.
Interpréter l’addition nucléophile sur le groupe carbonyle et la substitution nucléophile en termes d’interactions
frontalières.
Comparer la réactivité de deux entités à l’aide des orbitales frontalières.
Aucun calcul, tous les résultats (niveaux d'énergie, allure des OF ou coefficients de la combinaison linéaire sont
donnés).
Application aux réactions de chimie organique de sup
Solutions aqueuses
Oxydo-réduction :
Nombre d’oxydation.
Diagrammes de prédominance ou d’existence.
Identifier l’oxydant et le réducteur d’un couple.
Utiliser les diagrammes de prédominance ou d’existence pour prévoir les espèces incompatibles ou la nature
des espèces majoritaires.
Prévoir qualitativement ou quantitativement le caractère thermodynamiquement favorisé ou défavorisé d’une
réaction d’oxydo-réduction.
Savoir ajuster rapidement et efficacement une équation d'oxydo-réduction.
Acido-basicité :
Connaître la définition d'un acide en solution aqueuse, écrire l'équation de la réaction de dissociation dans l'eau
correspondant à la définition du Ka.
Connaître l'équation de la réaction d'autoprotolyse de l'eau et la constante Ke associée.
Déterminer la constante d'une réaction de titrage par combinaison linéaire d'équations (acidité, autoprotolyse)
("produit ou rapport des constantes d'équilibre, sans détailler les quotients de réaction).
1
/
1
100%