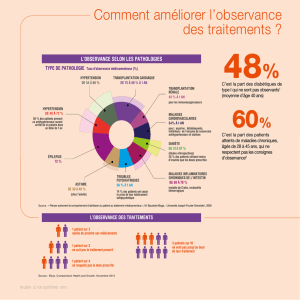
Traitement chimiothérapique des schizophrénies - Psychologie
publicité

¶ 37-295-A-10 Traitement chimiothérapique des schizophrénies P. Vandel, E. Haffen, D. Sechter La thérapeutique des schizophrénies a connu depuis une dizaine d’années de grands progrès, tant au niveau des approches psychosociales que médicamenteuses. La chimiothérapie reste la pierre angulaire du traitement d’attaque et d’entretien des schizophrénies mais ne peut et ne doit pas être dissociée des autres thérapies. Les nouveaux antipsychotiques ont apporté une meilleure qualité de vie par leur meilleure tolérance et meilleure efficacité sur les symptômes négatifs de la maladie. Dans ce guide thérapeutique, nous avons essayé de faire une synthèse des dernières directives concernant le traitement biologique des schizophrénies, contenues dans divers guidelines de parution récente anglais, australiens, nord-américains, canadiens et de la fédération mondiale des sociétés de biologie psychiatrique. Si les experts s’accordent pour préciser que tous les antipsychotiques existants ont une efficacité similaire, certaines particularités sont à noter concernant le traitement des différentes phases de la maladie. Nous détaillerons après une revue de données générales le traitement des phases aiguës du premier épisode et des rechutes, celui des phases avec réponse partielle ou avec résistance thérapeutique, puis le traitement d’entretien et prévention des rechutes. L’intérêt d’un traitement d’entretien continu semble évident du fait de la diminution de deux tiers des rechutes. Dans ce but, les nouvelles formes d’antipsychotiques retard améliorent l’observance et diminuent le risque de rechute et d’hospitalisation. © 2008 Elsevier Masson SAS. Tous droits réservés. Mots clés : Schizophrénie ; Chimiothérapie ; Antipsychotiques Plan ¶ Introduction 1 ¶ Évaluation et réévaluation du fonctionnement psychique et de l’état somatique Faire ou réévaluer le diagnostic Connaître l’histoire de la maladie Déterminer les symptômes cibles thérapeutiques et les hiérarchiser Faire un bilan organique du patient Créer une alliance thérapeutique 2 2 3 3 3 3 ¶ Données générales sur la chimiothérapie des schizophrénies Médicaments des schizophrénies Sur le choix de l’antipsychotique Posologie Durée de prescription et sevrage Association d’antipsychotiques Coprescription d’autres psychotropes Modalités de changement d’antipsychotique 3 3 3 4 5 5 5 6 ¶ Thérapeutique médicamenteuse du premier épisode aigu Premier épisode : traitement en urgence Premier épisode : traitement hors urgence Consensus 6 6 6 7 ¶ Thérapeutique médicamenteuse de la rechute aiguë Définition de rechute Rechute : traitement en urgence Rechute : traitement hors urgence 8 8 8 9 ¶ Thérapeutique médicamenteuse en cas de réponse inadéquate 9 Amélioration partielle et/ou persistance de symptômes dépressifs 9 Résistance thérapeutique 10 Psychiatrie ¶ Thérapeutique médicamenteuse d’entretien ou de prévention des rechutes Généralités Choix et modalités de prescriptions 11 11 12 ¶ Cas spécifiques Chez la femme Chez l’enfant Chez la personne âgée 12 12 13 13 ¶ Effets indésirables médicamenteux et leurs traitements Effets neurologiques Prise de poids Effets métaboliques Effets cardiovasculaires Autres effets secondaires 13 13 14 14 14 15 ¶ Observance thérapeutique Facteurs de prédiction de l’observance médicamenteuse des patients psychotiques Stratégies pour améliorer l’observance médicamenteuse 15 15 15 ■ Introduction Le but de la thérapeutique de cette maladie chronique invalidante est triple : • réduire, voire faire disparaître les symptômes ; • améliorer la qualité de vie et les facultés d’adaptation ; • maintenir l’amélioration clinique. Le thérapeutique chimiothérapique reste la pierre angulaire du traitement d’attaque et d’entretien des schizophrénies, mais il doit être mis en œuvre en association avec les abords psycho- 1 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies logique, institutionnel, familial, environnemental. Il ne faut pas oublier que cette thérapeutique est et ne peut être qu’un travail d’équipe. Les recommandations de ce guide d’aide au traitement ne représentent pas la seule approche de toutes les situations cliniques et ne peuvent pas être appliquées telles quelles. Elles doivent être personnalisées en fonction de tous les éléments cliniques et non cliniques recueillis pour chaque patient. L’historique des moyens thérapeutiques des schizophrénies et l’influence de ceux-ci sur la clinique de la maladie et son évolution déjà retracés par Vanelle [1] ne seront pas réabordés. Quatre domaines sont concernés par la mise en route et la modulation du traitement des schizophrénies (Canada) : • l’évaluation et réévaluation aussi bien du fonctionnement psychique que de l’état somatique ; • la thérapeutique médicamenteuse ou biologique ; • les interventions psychosociales ; • les services disponibles (équipe soignante spécialisée, structure d’accueil d’urgence ou à moyen ou long court, hôpital de jour, etc.). Dans ce document, nous aborderons de façon schématique et résumée le domaine d’évaluation et de réévaluation, étape nécessaire avant la mise en route de la chimiothérapie ou d’un traitement biologique. Concernant ceux-ci, nous détaillerons après une revue de données générales le traitement des phases aiguës du premier épisode et des rechutes, celui des phases avec réponse partielle ou avec résistance thérapeutique, puis le traitement d’entretien et la prévention des rechutes. Puis seront abordés les cas spécifiques rencontrés chez la femme, l’enfant et la personne âgée. Les problèmes de l’observance médicamen- Tableau 1. Bilan somatique conseillé teuse, si importante pour la réussite de cette thérapeutique, seront enfin évoqués après celui des effets indésirables et de leurs traitement. Ce travail, non sponsorisé par l’industrie, s’appuie principalement sur les guidelines et recommandations existants suivants : APA [2] (2004), australien [3] (2004), canadien [4] (2005), expert consensus [5] (2003), français [1] (2000), NICE (2003) [6], Treatment recommendations PORT [7] (2003), banque de données Cochrane [8], une analyse comparative de divers guidelines et de leur utilisation [9] (2005), ainsi que sur des revues de la littérature récente. ■ Évaluation et réévaluation du fonctionnement psychique et de l’état somatique (Tableau 1) Avant la mise en route d’un traitement chimiothérapique différentes étapes d’évaluation sont nécessaires. Faire ou réévaluer le diagnostic Le diagnostic se voudrait basé sur l’évolution de la maladie. Il semble que plus celui-ci est fait rapidement et plus le traitement est précoce, meilleur est le pronostic au long cours. Cependant une évaluation de cette notion par le système Cochrane [8] conclut à l’insuffisance d’essais permettant d’amener des conclusions définitives. Un traitement antérieur ayant modifié la symptomatologie initiale peut rendre ce diagnostic encore plus difficile. [2, 4]. Bilan somatique de base Examen clinique Examen biologique État général Pouls, tension État général NF Température ECG Électrolytes a BMI avant traitement c Fonction rénale b Fonction hépatique Fonction thyroidienne Bilan neurologique EEG, voire IRM Infectiologie d Hépatite, sida, syphilis Toxicologie Recherche de toxiques Grossesse Contre-indication de certaines molécules Recherche ou appréciation d’effets indésirables. À répéter après l’examen initial Examen clinique Examen biologique Effets extrapyramidaux, Parkinsonisme, dystonie, dyskinésie, akathisie Toutes les semaines en phase aiguë de traitement puis à chaque visite clinique (environ tous les 6 mois, plus souvent si patient à risque) Diabète 4 mois après chaque changement d’antipsychotique puis tous les ans ou plus fréquemment si prise de poids Diskynésie tardive Suivant la sensibilité du patient, tous les 3 à 6 mois si traitement par NLP classiques Hyperlipidémie Au début puis au moins tous les 2 à 5 ans. Tous les 6 mois si anomalies Tous les ans QT allongé ECG et dosage du potassium sanguin à surveiller avec les molécules affectant le QT Tous les 3 mois Fonction sexuelle et prolactinémie Après chaque changement de molécule, puis tous les ans Tous les 6 à 12 mois avec NLP Recherche de cataracte BMI b e a Ce bilan somatique s’ajoute à l’évaluation psychopathologique, ainsi qu’à celles des capacités cognitives et des niveaux de fonctionnement (social, condition de vie, activité), sans oublier la recherche d’antécédents familiaux de psychoses. Le guideline canadien préconise également la recherche clinique du syndrome de délétion du chromosome 21q11. a À suivre sous neuroleptique pour recherche de facteur de risque d’allongement de QT. b Détection de la limite de prise de poids acceptable (augmentation inférieure à une unité de BMI). Si plus, mise en route d’un programme de surveillance et d’une intervention ou changement de molécule. À calculer avant chaque changement de traitement, puis tous les mois pendant six mois puis tous les trois mois en phase de stabilité. Calcul du BMI : poids en kg/(taille m)2. Un BMI compris entre 25 et 29,9 signe un surpoids. Un BMI supérieur à 30 est corrélé à l’obésité. BMI (Body Mass Index) = IMC (indice de masse corporelle). c Surveillance plus particulièrement avec clozapine. d Si besoin. e Risque de certains neuroleptiques. 2 Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 Connaître l’histoire de la maladie Il est nécessaire de connaître l’histoire de la maladie et des éventuels traitements antérieurs, ainsi que l’environnement et le fonctionnement psychosocial du patient (isolement social, domicile ou non, emploi, problèmes judiciaires). Tous ces éléments permettent de personnaliser les suggestions des guides de prescription. Déterminer les symptômes cibles thérapeutiques et les hiérarchiser Mais que choisir sachant qu’ils se situent principalement dans trois domaines ? pensée, affect et cognition. Différents modèles sont retrouvés dans la littérature : • modèles à deux dimensions (ICD-10 [10] et DSM IV [11]), avec les manifestations positives ou délirantes et les manifestations négatives ou déficitaires ; • modèle à trois dimensions, avec syndrome de pauvreté psychique, syndrome de désorganisation, syndrome de distorsion de la réalité [12] ; • modèle à cinq dimensions, avec les dimensions positive ou délirante, cognitive ou de désorganisation, négative ou déficitaire, excitation-hostilité, angoisse et dépression [13] ; • modèle à sept dimensions, avec les manifestations positives, manifestations négatives, manifestations dépressives, manifestations et comportements suicidaires, abus de substances, comorbidité médicale, troubles liés à un stress posttraumatique [2]. Mais les profils thérapeutiques des psychotropes sont-ils suffisamment variés pour agir séparément sur chaque cible choisie ? Faire un bilan organique du patient Cet acte est nécessaire afin de connaître les éventuelles comorbidités et de détecter une organicité (Tableau 1). Cela permet également d’apprécier les facteurs de risques thérapeutiques, une contre-indication aux neuroleptiques ou une éventuelle précaution d’emploi, sans oublier la recherche de prise de toxiques. Ces bilans sont à répéter au cours du traitement, avec une fréquence variant suivant les patients et conditions de traitement, et comprennent alors la recherche des effets indésirables médicamenteux. En général, un bilan doit être fait avant mise sous traitement ou avant changement ou association de molécule. Ce bilan somatique s’ajoute à l’évaluation psychopathologique précédemment citée (symptomatologie positive, négative, désorganisation, humeur, risque suicidaire, agressivité ou impulsivité), ainsi qu’à celles des capacités cognitives et des niveaux de fonctionnement (social, condition de vie, activité), sans oublier la recherche d’antécédents familiaux de psychoses. Le guideline canadien [4] préconise également la recherche clinique du syndrome de délétion du chromosome 21q11. Créer une alliance thérapeutique Il s’agit enfin d’informer le patient, la famille, et de créer une alliance thérapeutique dont un des buts est d’améliorer l’observance [14], et donc le pronostic. Cette information peut se situer dès le début de la prise en charge du patient et doit être évolutive. Actuellement, l’évolution des pratiques cliniques et thérapeutiques ainsi qu’une meilleure connaissance des patients concernant ces pathologies rendent ce sujet d’actualité. Cette annonce est de pratique courante dans les pays anglo-saxons et en particulier aux États-Unis, mais plus difficilement instaurée en France. Cela est peut être lié au fait que cette pathologie demeure un des troubles psychiatriques les plus invalidants du fait du caractère potentiellement déficitaire de l’évolution. L’information des patients est considérée comme primordiale dans le cadre de la relation thérapeutique et de la qualité des Psychiatrie soins. Il apparaît donc légitime de répondre à cette demande des patients souffrant de schizophrénie en apportant une information complète et compréhensible sur la maladie et sa prise en charge [15]. ■ Données générales sur la chimiothérapie des schizophrénies Médicaments des schizophrénies La base de la thérapeutique médicamenteuse des schizophrénies repose sur les antipsychotiques qui sont utilisés dans toutes phases de la maladie en association avec les autres formes de thérapeutique non médicamenteuse. Ces antipsychotiques peuvent être associés à d’autres psychotropes comme les anticonvulsivants, les régulateurs de l’humeur, les anticholinergiques, les antidépresseurs et les benzodiazépines. Ces associations peuvent être utiles lorsque la réponse à l’antipsychotique seul est insuffisante, et pour le contrôle de troubles comportementaux, pour le traitement d’effets indésirables de l’antipsychotique, et pour le traitement de symptômes dépressifs ou anxieux. L’arrivée des antipsychotiques atypiques (AA) dans les années 1990 a entraîné une meilleure tolérance thérapeutique et a eu un impact positif sur les symptômes négatifs et affectifs des schizophrénies. La liste des antipsychotiques, leur profil thérapeutique et principaux effets indésirables sont présentés dans les Tableaux 2-4. En raison de l’évolution des mises sur le marché des antipsychotiques dans les différents pays, toutes les molécules qui existent dans les divers guidelines de référence figurent dans ce document. Sur le choix de l’antipsychotique Les experts s’accordent pour dire que tous les antipsychotiques existants ont une efficacité similaire lorsqu’ils sont prescrits à la posologie optimale. Les différences de profil d’effets indésirables vont fortement orienter le choix lors de la première prescription. Bien que d’activité thérapeutique comparable, l’assez bon rapport bénéfice/risque des AA en comparaison avec celui des antipsychotiques typiques (AT) entraîne une utilisation quasi-systématique des AA en premier choix, aussi bien au cours d’un premier épisode aigu que lors de rechute, ou que chez des patients souffrant d’effets indésirables liés aux AT. Les AA sont en effet associés à un plus faible risque d’effets extrapyramidaux, en particulier de dyskinésies tardives, et d’arrêt intempestif de traitement. Leur principal inconvénient est la prise de poids et le risque de diabète. Mais une étude récente (2006) (non commerciale) chez des patients dont la thérapeutique devait être changée pour des raisons cliniques (réponse insatisfaisante ou mauvaise tolérance) ne montre pas, sur un an, de supériorité des AA sur les AT en termes de qualité de vie, d’efficacité sur les symptômes et de coût des soins associés [16]. Dans de nombreux guidelines on retrouve les recommandations suivantes : • dans la mesure du possible le choix de l’antipsychotique doit être fait avec l’avis du patient informé ; • lorsqu’un patient est répondeur à un AT avec une bonne tolérance, il n’est pas conseillé de le changer pour un AA ; • les patients considèrent que les effets indésirables les moins bien tolérés sont les effets extrapyramidaux, la prise de poids, les troubles sexuels (souvent non rapportés), et la sédation ; • le risque de diabète et de prise de poids avec les molécules dont ce sont les effets indésirables connus doit être surveillé régulièrement. 3 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies Tableau 2. Principaux antipsychotiques de première génération Molécule Profil thérapeutique Chlorpromazine Cyamémazine [1, 2]. Effets indésirables prévalents Posologie initiale en mg/j Posologie moyenne en mg/j Anxiolytique, sédatif, Anticholinergiques, neurologiques à doses polyvalent à doses élevées élevées, photosensibilisation 25 à 300 50 à 600 Anxiolytique, sédatif 50 à 300 50 à 300 [1] 20 à 40 20 à 200 [1] 25 à 300 20 à 300 [1] Anticholinergiques, hypotension [1] 300 à 1 000 [2] Modérés Flupentixol Polyvalent Fluphénazine Polyvalent Halopéridol Neurologiques, anticholinergiques Antiproductif Neurologiques 1 5 à 20 [2] 2 à 30 [1] 5 à 20 [2] [1] Lévomépromazine Anxiolytique, sédatif Hypotension et anticholinergiques 25 à 200 50 à 200 Loxapine Polyvalent Modérés 75 à 200 100 à 600 [1] 10 à 50 150 à 400 [2] Mésoridazine Molindone 30 à 100 Perphénazine Antiproductif Neurologiques Pimozide Bipolaire Très modérés Pipothiazine bipolaire [2] 16 à 64 2à4 Neurologiques et anticholinergiques 5 à 20 [2] désinhibiteur 1 à 3 [1] antiproductif 4 à 6 [1] désinhibiteur 5 à 10 [1] antiproductif 15 à 30 Thioridazine 50 à 100 300 à 800 [1] [2] Arrêt commercialisation 2005 Thiothixène 6 à 10 15 à 50 [2] Trifluopérazine 2à5 15 à 50 [2] 10 à 20 50 à 100 Zuclopenthixol Antiagressivité, sédatif Modérés [1] NB : les molécules non disponibles en France ne sont pas détaillées en totalité. Tableau 3. Antipsychotiques de seconde génération. Molécule Profil thérapeutique Amisulpride Bipolaire a Aripiprazole Polyvalent Clozapine Polyvalent Réservé aux formes résistantes Olanzapine Polyvalent Effets indésirables prévalents Posologie initiale en mg/j Paliers d’augmentation de doses en mg/j Posologie moyenne en mg/j Endocriniens 50 à 800 100 50 à 200 désinhibiteur [1] 200 à 1000 antiproductif [1] 10 à 15 Leucopénie, agranulocytose hypersialorrhée, prise de poids Prise de poids Quétiapine 12,5 à 25 5 à 10 10 à 30 De 12,5 à 25 le 2e jour puis de 25 à 50 par jour De 2,5 à 5 tous les 3 à 4 jours 100 De 100 par jour [2] 200 à 500 [1] 300 à 600 [4] 150 à 600 [2] 5 à 20 [1] 10 à 20 [4] 10 à 30 [2] 600 [4] 300 à 800 Rispéridone Polyvalent Extrapyramidaux 0,5 à 1 De 0,5 à 1 tous les 3 à 4 jours Ziprasidone 2à6 [1, 4] 2à8 [2] 7 [2] [2] NB : les molécules non disponibles en France ne sont pas détaillées en totalité. a Effet sur symptômes négatifs à faible posologie, effet sur symptômes productifs à forte posologie. Posologie La posologie est celle recommandée par l’industrie (cf. autorisation de mise sur le marché). Les experts s’accordent pour débuter le traitement d’un premier épisode par les doses minimales, alors qu’elles pourront être plus fortes lors des épisodes suivants. Cependant, 40 % des patients ne répondent pas à la dose standard, obligeant à la prescription de doses plus élevées [6]. 4 En 2006, une étude européenne (Italie, Angleterre, Pays-Bas et Allemagne) rapporte que 28 % des patients sur la population étudiée (375) reçoivent une posologie excessive d’antipsychotiques au long cours [17]. Dans une autre étude, on relève le chiffre de 17 % de patients recevant une posologie supérieure à celle recommandée [9]. La posologie optimale dépend en effet de nombreux facteurs comme la présence de tels ou tels symptômes, les traitements Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 Tableau 4. Principaux antipsychotiques d’action prolongée. Molécule Présentation mg Dose moyenne /durée en mg/IM Conversion DOJ/DRT Décanoate de flupenthixol Ampoule 20 et 100 20 à 200, toutes les 2 à 4 semaines DRT = 5 DOJ Décanoate de fluphénazine Ampoule 25 et 125 25 à 250, toutes les 4 semaines DRT = 1/2 à 1 DOJ Décanoate d’halopéridol Ampoule 50 50 à 300, toutes les 4 semaines DRT = 10 à 20 DOJ Décanoate de zuclopenthixol Ampoule 200 100 à 400, toutes les 3 à 4 semaines DRT = 5 à 8 DOJ Acétate de zuclopenthixol semi-retard Ampoule 50 et 100 50 à 150, tous les 2 à 3 jours DRT = 2 à 3 DOJ Palmitate de pipothiazine Ampoule 25 et 100 25 à 200, toutes les 4 semaines DRT = 5 DOJ Rispéridone Ampoule 25, 37,5 et 50 25 à 37,5, tous les 14 jours + ou – 3 jours DRT = environ 10 DOJ DOJ/DRT: Dose orale journalière de la forme ordinaire/dose totale de la forme retard. antérieurs, la sensibilité médicamenteuse, la comorbidité. Elle dépend aussi de la capacité métabolique de chaque patient (métaboliseur lent, rapide, intermédiaire) qui peut être modifiée par de nombreux facteurs dont l’usage de tabac : celui-ci, étant inducteur enzymatique de certains cytochromes, peut diminuer l’efficacité des antipsychotiques. Les traitements associés sont les plus fréquents. En ce qui concerne les traitements associés, une baisse de la posologie est en général à prévoir lors de l’association de l’antipsychotique avec des inhibiteurs du CYP450 2D6 (fluoxétine, paroxétine par exemple) ou du CYP 3A4 (ketoconazole par exemple), et à l’inverse une augmentation de posologie est souvent nécessaire lors de l’association avec des inducteurs du CYP3A4 comme la carbamazépine (ex : la dose d’aripiprazole doit être doublée) [18]. La posologie massive de charge doit être évitée même lors d’épisodes nécessitant une sédation rapide. En ce qui concerne l’halopéridol, une posologie au-dessus de 12 mg/j n’apporterait pas de bénéfice thérapeutique supplémentaire. En ce qui concerne les AA la même évidence n’existe pas [6]. Les dosages plasmatiques, lorsqu’ils sont disponibles, sont utiles, ne serait-ce que pour suivre l’observance thérapeutique (dans 50 % des cas, ils sont utilisés dans ce but). C’est pour la clozapine que le service rendu est le plus utile et, comme pour l’halopéridol retard, le dosage sert également à l’ajustement posologique en cas de réponse insatisfaisante ou d’effets indésirables gênants. Mais en pratique, il existe plusieurs cas ou une association d’antipsychotique paraît utile : • lors de l’exacerbation de symptômes chez un patient recevant des antipsychotiques retard. Un AA, voire un AT (suivant l’histoire de la réponse thérapeutique du patient), peut être utile par voie orale pendant une courte période ; • lors d’une réponse insatisfaisante à plusieurs monothérapies bien conduites. C’est le cas le plus fréquent. Un résultat d’audit publié en 2002 révèle que sur 3 000 patients hospitalisés, une association d’antipsychotiques concerne environ la moitié d’entre eux [21]. Les études montrent qu’un AA est prescrit en première intention, et pour juguler des symptômes résistants à la monothérapie, un AT est coprescrit par la suite. Une étude européenne (Italie, Angleterre, Pays-Bas et Allemagne) rapporte que 13 % des patients sur la population étudiée (375) reçoivent une polythérapie d’antipsychotique au long cours [17] ; • lors d’un changement d’antipsychotique avec passage progressif de l’un à l’autre. L’association est le plus souvent de courte durée ; • lors de la résistance à un traitement par clozapine, une association avec un autre antipsychotique est une possibilité (cf. Thérapeutique médicamenteuse en cas de réponse inadéquate). Dans ces deux dernières indications, l’association semble acceptable par la plupart des experts. Coprescription d’autres psychotropes Durée de prescription et sevrage Un antipsychotique doit être essayé pendant trois à six semaines (voire huit semaines) avant de pouvoir juger de son inefficacité. En raison du risque de rechute après un épisode aigu, la poursuite du traitement médicamenteux doit être de un à deux ans après la fin de l’épisode. L’absence de traitement d’entretien s’accompagne dans 60 % des cas de rechute dans l’année qui suit l’épisode aigu. Le sevrage médicamenteux doit être progressif sous une étroite surveillance clinique à la recherche de signes d’une éventuelle rechute. Cette surveillance devrait durer encore deux ans après l’arrêt de la thérapeutique médicamenteuse. Association d’antipsychotiques Le texte des Références médicales opposables (RMO) sur la prescription de neuroleptiques du Journal Officiel du 14 novembre 1998 précise qu’il n’y a pas lieu, dans le traitement d’entretien de la psychose, d’associer deux neuroleptiques, même s’ils sont à polarité distincte, sauf si leur prescription est argumentée et périodiquement réévaluée. L’efficacité de l’association d’antipsychotiques est documentée [19] mais n’est pas établie. Il n’y a pas de données convaincantes justifiant une telle association. Son utilisation peut augmenter la probabilité d’effets indésirables et la prescription globale de plus fortes posologies. Il semble que cette comédication s’accompagne d’un risque accru de troubles métaboliques, bien que n’étant pas le seul facteur en cause [20]. Psychiatrie Les symptômes associés comme anxiété, dépression, manie sont traités par anxiolytiques, antidépresseurs, régulateurs de l’humeur. Anxiolytiques En phase aiguë, les anxiolytiques seuls peuvent suffire à améliorer anxiété, agitation, psychose. Mais l’action positive de l’anxiolytique (le lorazépam est souvent cité) associé aux antipsychotiques est reconnue par tous [22, 23]. Antiépileptiques et régulateurs de l’humeur Les antiépileptiques peuvent avoir une action positive à eux seuls mais sont plus utiles en général dans les cas de résistance thérapeutique : • la carbamazépine, l’acide valproïque sont indiqués en présence de symptômes dépressifs et de comportements violents et ou d’opposition, mais il n’y a pas de consensus quant à leur utilisation systématique dans le traitement des patients schizophrènes [22, 23] ; • la lamotrigine joue sur les symptômes positifs, négatifs, affectifs et cognitifs des schizophrénies [18]. L’association à la clozapine semble être particulièrement efficace en cas de résistance [22, 23] ; • la gabapentine peut être associée à un AA pour un meilleur contrôle de l’agitation ; • le lithium potentialise l’effet des antipsychotiques chez les patients souffrant de troubles de l’humeur associés et en cas de résistance thérapeutique. 5 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies Antidépresseurs “ Leur efficacité est manifeste lors de comorbidité dépressive et en présence de symptômes négatifs [2]. Clomipramine et fluvoxamine semblent être le bon choix en présence de troubles obsessifs-compulsifs ; le citalopram serait efficace chez les patients ayant un passé d’agression en réduisant les incidents [22, 23]. • Tous les antipsychotiques existants ont une efficacité similaire lorsqu’ils sont prescrits à la posologie optimale. • Dans la mesure du possible, le choix de l’antipsychotique doit être fait avec l’avis du patient informé. • Il faut surveiller les effets indésirables (rôle dans l’observance). • La posologie initiale doit être la plus faible possible, puis être ensuite adaptée. • Un antipsychotique doit être essayé pendant trois à six semaines (voire huit semaines) avant de juger de son inefficacité. • Le traitement doit être long pour éviter les rechutes après un épisode aigu (en années). • Il n’y a pas d’étude montrant la supériorité des associations d’antipsychotiques par rapport à la monothérapie, mais il existe de nombreuses raisons justifiant une telle association. • Lors de l’association d’antipsychotiques avec d’autres psychotropes, attention aux interactions médicamenteuses et aux nouveaux effets indésirables générés. • Attention au passage d’un antipsychotique à l’autre : prendre son temps. Autres molécules II n’existe que des rapports de cas isolés sur les autres associations possibles avec les antipsychotiques dans le traitement des schizophrénies [22, 23]. Ne pas oublier cependant que l’on ajoute en associant la possibilité d’effets indésirables supplémentaires. Une attention particulière doit être portée sur l’interaction des différentes molécules, interaction pharmacocinétique principalement au niveau de leur biotransformation par les cytochromes P450, interaction pharmacodynamique plus difficilement contrôlable. Parmi les psychotropes les plus générateurs d’interactions médicamenteuses figurent la fluoxétine, la fluvoxamine, la paroxétine et la carbamazépine. Modalités de changement d’antipsychotique Plusieurs stratégies de changement d’un antipsychotique pour un autre sont proposées, depuis celle de l’arrêt brutal ou progressif de la première molécule, alliée à la prescription graduelle ou brutale de la nouvelle molécule. Observation et patience doivent guider le prescripteur. Par prudence, afin d’éviter un possible rebond des symptômes lors du changement d’un antipsychotique pour une molécule dont l’affinité pour les récepteurs et la demi-vie sont différentes, il est recommandé de diminuer progressivement la posologie du premier antipsychotique tout en commençant le second à la posologie minimale. Si le premier antipsychotique était très sédatif, le changement pour un autre dénué de ces effets doit être encore plus progressif. En réalité, plus le profil pharmacodynamique de la deuxième molécule est différent de celui de la première, plus le passage de l’une à l’autre doit être lent : il peut atteindre jusqu’à cinq ou six semaines. Par exemple, dans le cas de changement de la clozapine, en raison d’effets indésirables majeurs, pour l’aripiprazole, le changement doit être très lent et peut parfois prendre plusieurs mois. Il semble que l’arrêt total de la clozapine soit en pratique très difficile, et une réduction de dose de 50 % avec l’association d’un AA peut être la solution [18]. En cas de réémergence d’anxiété, agitation, insomnie ou akathisie, il est possible temporairement d’administrer un anticholinergique ou un antihistaminique, qui peut être continué pendant deux à quatre semaines après l’arrêt du premier antipsychotique suivant les symptômes à corriger. Devant de tels signes cliniques, il ne faut pas obligatoirement penser que la molécule nouvellement introduite est inefficace pour le patient, car avec la plupart des antipsychotiques il faut une à deux semaines pour atteindre l’état d’équilibre des concentrations plasmatiques. . C’est lors du premier épisode que l’attitude vis-à-vis de la chimiothérapie d’emblée est la plus discutée. Elle permet d’éviter d’une part les traumatismes entraînés par la situation d’urgence [3, 6], aussi bien pour la famille, l’équipe soignante que pour le patient, surtout s’il est en ambulatoire. De toute façon, avec des attitudes thérapeutiques de prévention (réduction de stimulation, calme, réassurance verbale, anticipation de la violence) et après évaluation du risque de violence, on recommande une prudence quant à la chimiothérapie antipsychotique d’emblée. La posologie en est la plus faible possible au début de la prescription. En effet les patients, les jeunes en particulier, peuvent n’avoir jamais reçu d’antipsychotiques, et leur tolérance à ceux-ci n’est donc pas connue. Par ailleurs une cause organique, toxique doit être recherchée. Le rapport bénéfice/risque (effets indésirables essentiellement) peut faire préférer l’hospitalisation spécialisée [2] permettant peut-être de différer la chimiothérapie d’emblée. L’hospitalisation peut permettre aussi l’isolement du patient en cas de risque d’auto- ou hétéro-agression. Les méthodes chimiothérapiques de sédation d’urgence diffèrent suivant l’existence ou non d’agressivité. Elles peuvent être nécessaires même lors d’un premier épisode et sont les mêmes que chez un patient ayant déjà présenté des épisodes aigus, mais avec encore plus de retenue et de prudence. En cas de non agressivité, l’administration de benzodiazépines, voire d’olanzapine, se fait per os, en cas d’agressivité la voie d’administration privilégiée est parentérale (midazolam ou AA en intramusculaire). Enfin, il faut être formé et équipé pour éviter et traiter si nécessaire les risques d’une sédation d’urgence : réanimation cardiovasculaire, flumazénil (antagoniste des benzodiazépines). . 6 Premier épisode : traitement en urgence (Fig. 1) ■ Thérapeutique médicamenteuse du premier épisode aigu Le but recherché est d’abord symptomatique : calmer le patient, réduire le risque de violence, d’agressivité, et de souffrance du patient avant d’être curatif d’une pathologie. Il est également de préparer le patient au traitement au long cours en ménageant une alliance thérapeutique. Dans la mesure du possible une période d’observation et d’évaluation est nécessaire sans antipsychotique mais avec anxiolytique si besoin. À retenir Premier épisode : traitement hors urgence (Fig. 2) Seuls les antipsychotiques atypiques sont recommandés lors d’un premier épisode et à la posologie la plus basse de la fourchette recommandée. La posologie est ensuite augmentée progressivement si la réponse est insatisfaisante. Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 En urgence : sédation rapide 1er épisode ou rechute Hospitalisation si possible Évaluation clinique, biologique Patient non agressif Utiliser les doses minimales efficaces Risque de surdosage Limiter les associations Protéger la relation thérapeutique Patient agressif et/ou échec ou refus du 1er traitement i.m. : - midazolam 5 mg ou i.v. exceptionnellement - clonazépam 0,5 à 2 mg ou olanzapine - acétate de zupenthixol 10 à 20 mg - halopéridol 5 mg + lorazépam 4 mg (+ anticholinergique) Si refus du traitement parentéral, per os : Surveillance chlorpromazine 50 à 100 mg des signes vitaux Si pas de réponse à la voie parentérale : dropéridol (surveillance QT) Interventions de prévention diverses, observation, et si besoin per os : - benzodiazépines : lorazépam 1 à 2 mg (diazépam 5 à 10 mg pour certains mais non recommandé par NICE) - puis olanzapine 5 à 10 mg ou quétiapine 50 à 100 mg - halopéridol + anticholinergique (pour NICE) Hors urgence Figure 1. Arbre décisionnel. Traitement de l’épisode aigu en urgence Excellence. [3, 6] Choix de molécules Avec signes positifs prédominants La rispéridone serait le traitement de choix [5]. Les autres antipsychotiques atypiques arrivent groupés en deuxième position. En cas de choix d’un antipsychotique non sédatif, une association d’anxiolytique est conseillée (lorazépam par exemple). Avec signes négatifs prédominants Deux AA arrivent en tête : rispéridone et aripiprazole. Comme précédemment les autres AA sont regroupés dans le deuxième choix. Avec intrication de signes positifs et négatifs Le choix est le même qu’en présence de signes positifs prédominants. C’est la rispéridone qui est choisie en premier. Il n’y a pas de consensus sur l’utilisation d’un AA retard pour un premier épisode et la prescription d’AT par voie orale ou retard n’est pas recommandée. Choix de la posologie Certains guidelines [3] préconisent une augmentation très progressive des doses pendant les sept premiers jours jusqu’à une posologie de rispéridone deux milligrames, olanzapine orodispersible dix milligrammes, quétiapine trois cents milligrammes, amisulpride quatre cents milligrammes, aripiprazole quinze milligrammes. Ces posologies seront maintenues pendant trois semaines. En cas de réponse insatisfaisante, les posologies seront encore augmentées progressivement pendant quatre semaines (respectivement 4 mg, 20 mg, 600 mg, 800 mg, 30 mg). Psychiatrie . i.v. : intraveineuse. i.m. : intramusculaire. NICE : National Institute for Clinical Le choix posologique est le même lors des épisodes suivants. Consensus De nombreux auteurs s’accordent : • sur le fait qu’il faudrait privilégier la monothérapie ; • sur la préférence pour la voie orale ; • sur le choix d’antipsychotique atypique en première intention, non en raison de l’efficacité mais de la meilleure tolérance en aigu des antipsychotiques atypiques par rapport aux antipsychotiques typiques ; • sur la posologie d’antipsychotiques qui doit être initiée à la plus petite dose standard ; • sur la suppression de l’utilisation de dropéridol en raison du risque cardiovasculaire (allongement de QT, arythmie, mort subite). Pour les mêmes raisons l’emploi de thioridazine est peu recommandé ; • sur la clozapine qui ne doit pas être le premier choix lors d’un premier épisode de schizophrénie, sauf [3] éventuellement si un risque suicidaire est très important ou persistant ; • sur les antipsychotiques retards qui ne doivent pas être choisis lors d’un premier épisode ; • sur la surveillance clinique nécessaire après une thérapie associant plusieurs sédatifs avec suivi de : température, pouls, TA, fréquence respiratoire toutes les cinq à dix minutes environ pendant une heure, puis toutes les trente minutes jusqu’à ce que le patient se « réveille » ; • sur un traitement précoce, voire préventif des éventuels effets indésirables extrapyramidaux aigus (benztropine 1,2 mg intramusculaire ou intraveineuse, procyclidine 5,1 mg intramusculaire ou intraveineuse) afin d’éviter de donner à la chimiothérapie une mauvaise image et de préserver la relation thérapeutique. 7 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies Hors urgence : étape 1 - monothérapie si possible 1er épisode Rechute Avec signes positifs Recherche des causes Avec signes négatifs Avec signes positifs Rôle du patient dans le choix de l'antipsychotique Avec les deux 1 - rispéridone + anxiolytique si besoin 2 - autres AA Choix de posologie (cf. Vidal®) Faible au départ Attendre 3 à 6 semaines avant de changer de molécule si besoin Si le patient va bien et a une bonne tolérance, traitement à poursuivre 1 à 2 ans et surveillance Avec les deux Avec signes négatifs 1 - rispéridone 2 - aripiprazole - ziprazidone - olanzapine - quétiapine - atypiques retard 3 - clozapine 4 - typiques retard Si symptômes maniaques : - régulateur humeur Si symptômes dépressifs : - antidépresseurs IRS ou IRSNa (1 an) 1 - rispéridone - aripiprazole - ziprazidone 2 - olanzapine - quétiapine - atypiques retard - clozapine 3 - typiques retard 1 - rispéridone - aripiprazole - ziprazidone - olanzapine 2 - atypiques retard - quétiapine - clozapine 3 - typiques retard Choix de posologie « plus forte » que pour le 1er épisode Si après 3 à 8 semaines évolution non satisfaisante étape 2 Dans tous les cas : si besoin, benzodiazépine Si le patient va bien : traitement durée minimum 5 ans et surveillance Figure 2. Arbre décisionnel. Traitement de l’épisode aigu hors urgence [5, 6]. AA : antipsychotiques atypiques ; IRS : inhibiteur de la recapture de la sérotonine ; IRSNa : inhibiteur de la recapture de la sérotonine et noradrénaline. . “ À retenir Lors d’un premier épisode : voie orale de préférence. Benzodiazépines en premier choix puis AA, posologie la plus faible possible, antipsychotiques retard (AA ou AT) non recommandés. Surveillance importante surtout si sédation d’urgence. ■ Thérapeutique médicamenteuse de la rechute aiguë Définition de rechute Elle varie d’une étude à l’autre, certaines incluant la nécessité d’une hospitalisation, ou une aggravation de trois (ou plus) symptômes ou la non réponse à l’augmentation de posologie, etc. Ce peut être plus simplement la réémergence des symptômes après une période de rémission. La rechute est une caractéristique de cette maladie de nature cyclique. Elle est plus fréquente dans les cinq premières années de la maladie et le risque de rechute persiste chez environ 80 % des patients. Il faut dans la démarche thérapeutique distinguer la rechute par mauvaise observance de la rechute malgré un traitement bien suivi. 8 Rechute : traitement en urgence (Fig. 1) Patient sans agressivité La première option est l’administration orale de benzodiazépines, par exemple lorazépam 1,2 milligrammes (posologie parfois plus élevée en cas d’abus de substances et de dépendance). L’administration de diazépam cinq à dix milligrammes est à éviter dans le guideline NICE [6] mais non dans les autres. Ces molécules diminuent la détresse, l’insomnie et les désordres comportementaux immédiats secondaires à la psychose et permettent d’attendre l’effet des antipsychotiques si besoin [22]. L’option suivante est un antipsychotique atypique (excepté clozapine), olanzapine cinq à dix milligrammes (orodispersible), quétiapine 50 à 100 milligrammes (meilleure tolérance) [2, 6]. Certains auteurs déconseillent la prescription d’halopéridol en l’absence d’agressivité, car il est peu sédatif et associé à un mauvais profil de tolérance (éviter l’image du mauvais médicament). Patient agressif ou refusant la prise orale ou en cas d’échec de la prescription précédente Une administration par voie parentérale est justifiée : midazolam cinq milligrammes intramusculaire [3] (certains cliniciens préfèrent la voie intraveineuse pour sa rapidité et prédictibilité d’action). En raison du risque potentiel de dépression respiratoire (plus importante chez les personnes âgées et majorée par la prise concomitante d’autres sédatifs, la consommation de Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 stupéfiants ou de traitements substitutifs), la proximité d’équipement de réanimation et la possibilité d’une injection de flumazénil (antagoniste des benzodiazépines) doivent être prévues ainsi qu’une surveillance clinique d’au moins deux heures. La sédation est rapide, de cinq à quinze minutes, et d’une durée de quelques heures. Cette prescription est moins risquée que l’administration de dropéridol (problème de QT) ou d’halopéridol moins sédatif et moins bien toléré (effets extrapyramidaux dont on doit prévenir la survenue avec des anticholinergiques). Cependant, l’halopéridol per os ou intramusculaire cinq milligrammes seul, ou associé au lorazépam quatre milligrammes, reste une alternative proposée par les Anglais [6] : il y aurait une preuve d’une supériorité de rapidité d’effet de l’association par rapport à l’halopéridol intramusculaire seul (prévoir un anticholinergique). Une alternative est la prescription de clonazépam intramusculaire 0,5 à 2 milligrammes ou d’olanzapine intramusculaire [3], voire d’acétate de zupenthixol. En cas de refus de la voie parentérale, on conseille chlorpromazine 50 à 100 mg par voie orale [3]. La voie intramusculaire n’est pas recommandable pour les Anglais [6]. médicamenteuse). Les régulateurs de l’humeur sont préférés aux antidépresseurs en cas d’antécédents personnels ou familiaux de cyclothymie (ou bipolaire II). Les autres antidépresseurs ne sont choisis qu’en seconde ligne. Si la réponse est bonne, le traitement associé devrait être poursuivi pendant un an avant une décroissance progressive de posologie puis arrêt. Choix de la posologie Les posologies d’AA peuvent être augmentées si besoin tant que la tolérance est bonne. “ À retenir Lors des rechutes, après recherche des causes, optimiser la posologie de la première molécule. Ensuite, changer et essai d’AA, surveiller l’observance. Les AA retard puis la clozapine puis les AT retard sont des choix successifs. . Rechute : traitement hors urgence (Fig. 2) Comme lors de la résistance thérapeutique, il faut éliminer une mauvaise observance. Celle-ci est souvent liée à une mauvaise tolérance. Le choix d’une nouvelle molécule mieux tolérée (souvent AA) est alors préconisé, avec un accompagnement psychosocial. Avant de changer de molécule, il faut optimiser la posologie de la première molécule et rechercher d’autres causes de rechute (associations médicamenteuses, abus d’alcool ou de substances, comorbidité). Les AA doivent être prescrits chez les patients ayant déjà été traités par AT avec une efficacité médiocre ou souffrant d’effets indésirables gênants. Si un traitement par AT a été efficace et bien toléré, il peut être réintroduit. Il est nécessaire de convaincre le patient et son environnement de respecter la durée de traitement de l’épisode (un à deux ans), et de bien contrôler l’observance. Choix de la molécule Bien que d’efficacité peu différente, des choix préférentiels des antipsychotiques se dessinent suivant la symptomatologie. Avec signes positifs prédominants La rispéridone serait un premier choix, avant les autres AA [5]. Viennent ensuite les AA retard ainsi que la clozapine. Les AT retard ne figurent qu’en dernier choix. Avec signes négatifs prédominants En présence de signes négatifs prédominants, rispéridone, aripiprazole, ziprazidone sont choisis avant les autres AA et leur forme retard et la clozapine. Comme précédemment les AT retard ne figurent qu’en dernier choix. Avec intrication de signes positifs et négatifs Rispéridone, aripiprazole, ziprazidone et olanzapine représentent le premier choix avant les AA retard et la clozapine, la dernière place échouant encore aux AT retard. Avec intrication de symptômes affectifs [3] En cas de symptômes de type maniaque, l’association de régulateurs de l’humeur à de faibles doses d’AA est conseillée. Des benzodiazépines peuvent être utiles afin d’obtenir une sédation rapide. En présence de symptômes dépressifs, un antidépresseur inhibiteur de la sérotonine peut être associé à l’antipsychotique à faible dose (tout en tenant compte du risque d’interaction Psychiatrie . ■ Thérapeutique médicamenteuse en cas de réponse inadéquate (Fig. 3) Amélioration partielle et/ou persistance de symptômes dépressifs La persistance de symptômes positifs ou négatifs ou la présence de symptômes dépressifs (à distinguer des effets indésirables des antipsychotiques et des symptômes négatifs primaires des schizophrénies) se traduit par une amélioration insatisfaisante. Avant modification thérapeutique, les causes de réponse insatisfaisante sont recherchées. Recherche et traitement des causes de mauvaise réponse • Posologie inadaptée, le plus souvent trop faible. L’augmentation de posologie est requise. • Mauvaise observance dont la cause est recherchée. Si aucune cause n’est trouvée, un antipsychotique retard injectable est préféré à une forme orale. • Mauvaise tolérance. Si la raison de mauvaise observance est la mauvaise tolérance d’un antipsychotique, un traitement correcteur est éventuellement prescrit, mais le plus souvent un antipsychotique d’une autre famille lui est substitué. • Abus de substances, comorbidité, associations médicamenteuses peuvent à elles seules entraîner des symptômes dépressifs. Changement d’antipsychotique Trois à six semaines (voire huit semaines pour certains auteurs) sont requises avant de juger de l’efficacité d’un antipsychotique et de sa posologie. Si la réponse est partielle, une adaptation posologique est alors à envisager sur quatre semaines. Si la réponse est absente, un changement d’antipsychotique est préconisé. On choisit un antipsychotique d’une autre famille que celle prescrite précédemment. Si après cinq à dix (voire onze) semaines avec la molécule suivante et avec adaptation de la posologie l’efficacité n’est pas satisfaisante, on se réfère à la conduite à tenir en cas de résistance. Association avec d’autres familles de psychotropes En cas de signes dépressifs Si l’association d’un antidépresseur sérotoninergique n’est pas efficace, un changement pour un antidépresseur inhibiteur 9 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies Hors urgence : étapes 2 et 3 Après 3 à 8 semaines d'étape 1 Amélioration partielle ou absente ou trouble de l'humeur Causes ? Étape 2 Mauvaise observance Mauvaise tolérance Augmenter la posologie puis si besoin choisir antipsychotique d'une autre famille Et si besoin Rechercher les causes Antipsychotique retard injectable : AA premier choix Association médicamenteuse - Régulateur humeur - Antidépresseur IRS ou IRSNa ou un 2e antipsychotique atypique associé Choisir antipsychotique d'une autre famille Patienter 5 à 11 semaines en contrôlant l'observance Résistance après essai du 2e antipsychotique Étape 3 Clozapine Et si besoin Augmenter posologie clozapine Résistance clozapine Li + antipsychotique ayant donné le meilleur résultat pour le patient ou clozapine + AT Échec ECT Si symptômes sévères, catatonie, idées suicidaires importantes But Amélioration satisfaisante et bonne tolérance Traitement de stabilisation avec même molécule, même posologie ou ECT d'entretien chez répondeur ECT Durée de prescription à maintenir 1 à 2 ans 1er épisode après amélioration + surveillance 2e épisode Durée de prescription à maintenir 5 ans minimum + surveillance Figure 3. Arbre décisionnel. Traitement de l’épisode aigu hors urgence si réponse inadéquate : étapes 2 et 3 [2, 5, 6]. AT : antipsychotiques typiques ; AA : antipsychotiques atypiques ; Li : lithium ; ECT : électroconvulsivothérapie ; IRS : inhibiteur de la recapture de la sérotonine ; IRSNa : inhibiteur de la recapture de la sérotonine et noradrénaline. spécifique de la recapture de la sérotonine et noradrénaline (IRSNA) est conseillé. Le choix d’un antidépresseur tricyclique n’arrive qu’en dernier lieu avant celui de la sismothérapie. Les posologies sont les mêmes que celles utilisées dans les troubles de l’humeur hors pathologie schizophrénique. Les régulateurs de l’humeur sont conseillés lors de symptômes de type maniaque mais aussi dépressifs lorsque les antécédents de bipolarité sont présents. L’amélioration des symptômes négatifs et dépressifs persistant chez un patient traité par amisulpride a été obtenue par l’association de pergolide [24]. En cas de risque suicidaire Le suicide est la première cause de mortalité chez les patients schizophrènes (10 à 13 % des patients). Le risque suicidaire doit être recherché et surveillé avec soin et, s’il est présent, il est fortement conseillé d’associer les thérapeutiques médicamenteuses, psychothérapeutiques et psychosociales. La clozapine est conseillée dès que ce risque est important. En cas de résistance à la clozapine et de risque suicidaire majeur, une sismothérapie est proposée. Résistance thérapeutique Après la recherche des causes de résistance et avant l’intervention pharmacologique, l’optimisation de l’intervention psychosociale est recommandée. 10 Définition de la résistance thérapeutique Pour Kane et al. [5], la définition élaborée en 1988 et rapportée par Vanelle [1] implique l’absence pendant les cinq dernières années de bénéfice thérapeutique, malgré : • l’administration de trois séquences de neuroleptiques (NLP) ; • d’au moins deux familles différentes ; • durant au moins six semaines ; • avec une posologie seuil de 1 000 mg/j en équivalent chlorpromazine. Plus récemment, on parle de résistance thérapeutique lorsqu’il y a absence de réponse à la prescription successive de deux antipsychotiques, dont un AA, prescrits à bonne posologie et avec une bonne observance, et chacun pendant une durée suffisante de six à huit semaines [6]. Recherche et traitement des causes de non réponse • Posologie inadaptée. • Mauvaise observance dont la cause doit être recherchée. Si la raison en est une mauvaise tolérance, un antipsychotique d’une autre famille est substitué. Sinon, un antipsychotique retard injectable est préféré. Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 • Abus de substances, comorbidité, association médicamenteuse. Choix de la clozapine La clozapine est choisie en premier lieu en cas de résistance confirmée. Ce choix de stratégie est plus efficace dans ce type de traitement que l’essai d’autres AA [25, 26]. Cependant, environ 40 à 70 % des cas de résistance aux antipsychotiques sont non répondeurs à la clozapine [27]. Si le résultat est médiocre, une augmentation de posologie de la clozapine est préconisée. En l’absence de résultats satisfaisants avec la clozapine, le lithium peut être prescrit en association avec l’antipsychotique qui avait donné précédemment le meilleur résultat pour le patient [3]. Il est possible ensuite si le résultat insatisfaisant persiste d’ajouter un autre antipsychotique à la clozapine dans certaines circonstances. Si l’ajout d’un AT s’accompagne d’une augmentation d’effet thérapeutique, le risque d’effets indésirables extrapyramidaux est également majoré [28]. Cette association clozapine/AT concernerait un tiers des patients traités par clozapine [6, 27]. Dans la littérature, les rapports de cas concernent la coadministration de pimozide, sulpiride, olanzapine, loxapine et rispéridone. Cependant, rien ne prouve que le bénéfice observé soit dû à l’association et non au second antipsychotique seul car peu d’informations concernant le traitement antérieur ne sont disponibles [27]. Sismothérapie La sismothérapie est en premier lieu réservée aux patients souffrant d’effets indésirables majeurs avec les antipsychotiques et aux patients dont la pathologie est résistante après essai de la clozapine. Elle est ensuite conseillée en présence de catatonie, et si les symptômes sont sévères, si la violence est exacerbée et également en cas d’épisodes dépressifs sévères ou de risque suicidaire important [5]. Cette thérapeutique est alors conseillée même lors d’un premier épisode avec de bons résultats immédiats et une bonne tolérance même chez les personnes âgées et même en association avec des antipsychotiques [29, 30]. Choix d’une autre thérapeutique La piste glutamatergique est encore jeune. Une nouvelle stratégie de traitement des formes résistantes à la clozapine propose l’association d’un antipsychotique et de lamotrigine [31]. Mais une analyse de données de la littérature [32] n’aboutit pas à une conclusion favorable quant à l’association de molécules glutamatergiques et d’antipsychotiques. La stimulation magnétique transcranienne en association avec des antipsychotiques semblerait efficace sur les symptômes négatifs et peu ou pas sur les hallucinations auditives [22, 23]. ■ Thérapeutique médicamenteuse d’entretien ou de prévention (Fig. 4) des rechutes [6, 7, 33] Les stratégies thérapeutiques de traitement au long cours comportent des interventions médicamenteuses mais aussi psychosociales dont les thérapies familiales, les thérapies cognitives et comportementales. Elles doivent être utilisées conjointement. Généralités But poursuivi Il s’agit d’éviter ou de raccourcir les périodes de rechutes, mais dans des conditions de bonne qualité de vie. Ici encore les Maintien du traitement de la phase aiguë (pas de baisse de posologie) 1er épisode Rechute Durant 1 à 2 ans Durant 5 ans minimum et plus si nombreuses rechutes Information patient, famille ECT d'entretien avec ou sans antipsychotique pour patients répondeurs Surveillance de l'observance Si mauvaise observance : antipsychotique retard (AA premier choix ou AT suivant tolérance) Si apparition d'effets indésirables majeurs* changer d'antipsychotique (autre famille) Si symptômes affectifs : régulateur de l'humeur ou antidépresseur (tricyclique dernier choix) Continuer toutes les thérapies psychosociales Figure 4. Arbre décisionnel. Traitement d’entretien et prévention des rechutes [2]. * Effets indésirables à rechercher : extrapyramidaux, akathisie, prise de poids, diabète, troubles sexuels, somnolence, troubles visuels, hyperlipidémie. AT : antipsychotiques typiques ; AA : antipsychotiques atypiques ; ECT : électroconvulsivothérapie. Psychiatrie 11 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies “ Antipsychotiques oraux À retenir Démarche logique et patiente Première étape : • recherche des causes ; • adaptation de posologie ; • changement de molécules (choix d’une autre famille) ; • association d’antipsychotiques ou autres psychotropes si besoin. Deuxième étape : • clozapine seule ; • adaptation posologique ; • associations psychotropes ; • sismothérapie. antipsychotiques sont nécessaires, de plus ils facilitent les traitements psychologiques. Toutes les études sur plusieurs années montrent que la prescription d’antipsychotiques s’accompagne d’une réduction des deux tiers du risque de rechute. Après un premier épisode, 82 % des patients non traités par antipsychotiques rechutent dans les cinq ans. Cependant il n’est pas certain que tout patient doive recevoir un traitement d’entretien. Environ 20 % d’entre eux n’ont qu’un épisode, et 20 % rechutent sous traitement au long cours [6]. Malgré cela il est fortement conseillé dans tous les guidelines de maintenir un traitement antipsychotique sauf peut-être si l’épisode aigu a été très bref et sans conséquence psychosociale négative. Il est aussi conseillé de préparer le patient à l’éventualité de la rechute afin de pouvoir intervenir précocement. Causes de rechute Plusieurs facteurs concourent à favoriser une rechute chez un patient : • des événements et stress de la vie, un isolement psychosocial, une condition sociale défavorisée ; • la mauvaise tolérance médicamenteuse, particulièrement avec des AT ; • l’abus d’alcool ou de substances illégales ; • les patients avec des symptômes résiduels, plus particulièrement affectifs comme une dépression ont plus de risque de rechuter. Choix et modalités de prescriptions Généralités Le choix du médicament se fait avec le patient (s’il est satisfait d’une molécule son avis prime), et concerne aussi bien les formes orales que retard. Il n’y a pas de différence significative dans l’efficacité de ces deux formes. Il n’y a pas d’étude montrant la supériorité d’une molécule sur les autres dans la prévention des rechutes. Là encore, la monothérapie est souhaitable sauf temporairement en cas de changement d’une molécule pour une autre. La prescription discontinue (intermittente) de l’antipsychotique dans le traitement d’entretien n’est plus recommandée en raison du risque d’aggravation des symptômes et de rechutes, sauf bien sûr en cas de refus de traitement continu par le patient et d’effets indésirables gênants [6]. La posologie standard est utilisée. En fait, elle doit rester la même que celle qui a amené l’amélioration de la phase aiguë. Un tel traitement doit être poursuivi au minimum un à deux ans [6] ou plus (cinq ans) [2, 5]. 12 AT ou AA ? Qu’il soit typique ou atypique, l’antipsychotique qui a été bien toléré et qui a amené une amélioration clinique satisfaisante sera poursuivi. Bien qu’il n’y ait pas d’étude montrant la supériorité d’une molécule sur les autres dans la prévention des rechutes, dans quelques études de bonne qualité, le taux de rechute semble moins élevé chez les patients traités par AA (20 à 30 %) que par AT (50 %) [33]. La meilleure tolérance globale entraînant une meilleure observance joue peut-être un rôle. Le choix s’oriente vers un AA chez un patient dont le diagnostic est récent. Il n’est pas recommandé de changer de molécule pour le traitement d’entretien sauf en cas d’apparition d’effet indésirable gênant (extrapyramidal) avec un AT, et un AA sera alors préféré. Par contre, si les effets indésirables avec un AA sont marqués (prise de poids, diabète, hyperlipidémie), le changement de molécule pour un AT est justifié. Antipsychotiques retard Forme orale ou forme retard ? Jusqu’à l’apparition de forme retard d’AA, un traitement retard avait les désavantages de la tolérance médiocre des AT et était réservé aux patients dont l’observance thérapeutique laissait à désirer. Mais malgré leurs inconvénients, les AT retard se sont montrés plus efficaces que les formes orales dans la prévention des rechutes. Les molécules retard sont actuellement réservées à deux catégories de patients : ceux qui en expriment la préférence et ceux dont l’observance thérapeutique est médiocre (encore faut-il dans ce cas que le patient respecte le rythme des injections). La posologie et les dates de prises ou injections sont déterminées en fonction des données de l’industrie pharmaceutique et des caractéristiques cliniques et biologiques du patient, ainsi que des associations médicamenteuses présentes. L’utilisation de dose test est préconisée [6] . Il est démontré que les doses standard sont plus efficaces en prévention des rechutes que des plus petites doses, et les doses supérieures aux standards ne sont pas plus efficaces. Enfin, les formes retard des AT ne génèrent pas plus de mouvements anormaux que les formes orales. Sismothérapie d’entretien Elle est à envisager pour les patients répondeurs à cette thérapeutique. Les patients âgés peuvent bénéficier de cette approche. La fréquence est à augmenter si une rechute survient [30]. Surveillance au cours du traitement Une surveillance clinique régulière doit rechercher, outre les symptômes résiduels de la maladie, les effets indésirables des psychotropes prescrits, avec une attention particulière pour les effets neuroendocriniens (diabète, hyperprolactinémie) et pour les effets cardiovasculaires (tension artérielle et lipidémie). Le poids et l’indice de masse corporelle doivent être mesurés au début du traitement et contrôlés une fois par mois pendant six mois, puis tous les trois mois par la suite. La glycémie et la lipidémie sont évaluées au début du traitement puis surveillées régulièrement. Les comorbidités doivent être détectées (abus de substance, alcoolisme), ainsi que la survenue d’une autre pathologie. ■ Cas spécifiques Chez la femme Antipsychotiques et sexe La pharmacodynamie et la pharmacocinétique des antipsychotique varieraient en fonction du sexe [34] . Ce sont des Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 “ Chez la personne âgée À retenir • Le traitement d’entretien continu élimine les deux tiers des rechutes. • Poursuivre l’antipsychotique qui a donné la meilleure réponse, à la même posologie. • Antipsychotique per os ou retard suivant choix du patient. • Antipsychotique retard si suspicion de mauvaise observance. Consensus Un consensus se dessine pour l’utilisation des antipsychotiques chez la personne âgée [40]. Pour le traitement des schizophrénies, le choix des experts se porte en première ligne sur la rispéridone (1,25 à 3,5 mg/j). La quétiapine (100 à 300 mg/j), l’olanzapine (7,5 à 15 mg/j), l’aripiprazole (15 à 30 mg/j) sont en seconde ligne. Un traitement à vie à la dose minimale efficace est conseillé. En cas de comorbidité Diabète, dyslipidémie, obésité facteurs liés au sexe comme le régime, le tabac (plus fréquent chez l’homme), les médicaments associés (plus fréquents chez la femme), l’exercice musculaire, le volume de distribution du médicament (plus important chez la femme), les variations hormonales qui feraient la différence. Dans cette étude, la posologie efficace est en général plus faible (deux fois moins forte) chez la femme que chez l’homme. De plus, la tolérance serait différente [35] : certains effets indésirables comme prise de poids, passivité, hypotension, allongement de QT, hyperprolactinémie seraient plus marqués et moins bien supportés chez la femme. Antipsychotiques et grossesse Il existe deux périodes à risque : le premier trimestre, avec risques de malformations, et la naissance avec risque de syndrome de sevrage. Il est bien sûr conseillé de choisir toutes les options thérapeutiques non médicamenteuses et particulièrement pendant les semaines six à dix (période sensible pour les risques de tératogenèse), tous les antipsychotiques passant le placenta et dans le lait [34]. Pendant la grossesse, l’utilisation d’antipsychotiques est classiquement indiquée lorsque pour le foetus le risque d’exposition au médicament est plus faible que le risque encouru par la mère si la maladie n’est pas traitée. Il est conseillé d’utiliser les posologies les plus basses avant l’accouchement, (risque de syndrome de sevrage du nouveau-né) et d’augmenter immédiatement les doses pendant le post-partum en raison du risque de décompensation [36]. Les antipsychotiques n’entraînent pas ou peu de risque de malformations chez le foetus [36]. Les régulateurs de l’humeur et benzodiazépines ont un plus fort risque de tératogénèse. Cependant, les données manquent en ce qui concerne les études comparatives d’antipsychotiques ainsi que leur influence sur le développement plus tardif des enfants. Chez l’enfant Le traitement est multimodal (comportemental, social, scolaire, familial et médicamenteux). Chez l’enfant en-dessous de douze ans, le peu de données disponibles dans la littérature permet de dire que ce sont des AA qui sont prescrits. La rispéridone et l’olanzapine sont efficaces, et la clozapine est réservée aux résistances thérapeutiques. En 2006, les informations manquaient encore pour les molécules plus récentes [37]. Chez le jeune de sept à seize ans présentant une résistance à deux antipsychotiques, un essai comparatif sur le devenir à deux ans suggère un meilleur effet de la clozapine par rapport à l’olanzapine (prescrits pendant huit semaines). Cependant, la tolérance est moins bonne [38]. Enfants et adolescents semblent plus sujets que l’adulte aux effets indésirables de type métabolique et endocrinien avec les antipsychotiques [39]. Psychiatrie Les experts conseillent d’éviter la clozapine, l’olanzapine ainsi que les AT. Ils préconisent rispéridone, puis quétiapine en second choix. Maladie de Parkinson La quétiapine est le premier choix. Insuffisance cardiaque et QT long Il faut éviter la clozapine, ziprasidone et les AT. Un quart des experts contre-indiquent les associations suivantes : clozapine + carbamazépine, ziprazidone + antidépresseurs tricycliques, AT + fluoxétine. Ils conseillent de prendre en compte le potentiel inhibiteur enzymatique de certains antidépresseurs sérotoninergiques (fluoxétine, fluvoxamine, paroxétine, sans oublier le potentiel inducteur enzymatique de la carbamazépine). ■ Effets indésirables médicamenteux et leurs traitements [2, 4, 22, 23] Les effets indésirables des antipsychotiques sont variés : neurologiques, métaboliques, sexuels, endocriniens, cardiovasculaires et sédation. Ils sont aussi prédictibles en fonction du profil d’activité de l’antipsychotique au niveau des récepteurs. Ces effets sont à prendre en compte pour le choix du traitement au long cours, mais beaucoup moins dans le traitement d’urgence (où il faut les prévenir). Si les AA ont des avantages par rapport aux AT quant aux effets neurologiques et l’atteinte cognitive, il ne faut pas négliger les risques de diabète et de prise de poids. Une bonne surveillance de l’apparition de ces effets améliore l’observance thérapeutique. Pourtant, 53 % des patients ne reçoivent pas un traitement adéquat contre les effets indésirables des antipsychotiques [9]. Effets neurologiques Effets extrapyramidaux Ils sont classiquement divisés en effets aigus (dystonie aiguë, parkinsonisme, akathisie) et chroniques (akathisie et dyskinésie tardive). Les effets aigus apparaissent dans les premiers jours ou semaines de traitement, sont dose-dépendants et réversibles à la diminution de posologie ou à l’arrêt du traitement. Les spectaculaires et angoissantes dystonies aiguës sont liées aux AT et répondent très bien aux anticholinergiques et antihistaminiques, pour lesquels une administration parentérale est recommandée (rapidité d’action) [2]. Parkinsonisme Il affecte 10 à 80 % des patients suivant les doses et régresse bien (en général) à l’arrêt du traitement. Il est souhaitable de le prévenir en prescrivant de faible doses, car les médicaments 13 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies correcteurs (agonistes dopaminergiques et anticholinergiques) engendrent leurs propres effets indésirables (exacerbation psychotique et effets anticholinergiques). Les traitements de l’akathisie (20 à 25 % des patients) ne sont pas bien validés : les anticholinergiques et les benzodiazépines ont été proposés. Une réduction de posologie et l’administration de bêtabloquants (propranolol 30 à 90 mg/j) semblent actives [20, 21]. Mis à part la clozapine, les AA n’induisent pas ou peu cet effet. Dyskinésies tardives 4 à 8 % par année de traitements soit 20 % après 4 ans. Aucune étude contrôlée n’a été faite pour clarifier le rôle des antipsychotiques dans le traitement des dyskinésies tardives. Cependant, dans les formes sévères, la clozapine est recommandée comme correcteur mais aussi en remplacement de l’antipsychotique responsable de l’effet indésirable. Syndrome malin des neuroleptiques Il est caractérisé par hyperthermie, rigidité, tachycardie, confusion, myoglobinurie, élévation des CPK, des leucocytes et des enzymes hépatiques. Le traitement antipsychotique doit être immédiatement arrêté et les fonctions vitales contrôlées. Le patient doit être transféré en soins intensifs. Des benzodiazépines peuvent être administrées [22, 23]. Crises comitiales Elles surviennent dans 0,5 à 0,9 % des cas, mais avec la clozapine (posologie > 500 mg/j) et la zotépine, l’occurrence dose-dépendante est de 2 à 17 %. Il faut noter que l’arrêt du tabac supprime l’induction enzymatique du cytochrome 1A2, et diminue donc l’élimination de la clozapine, favorisant un surdosage [4] . On recommande d’abord une réduction de posologie de l’antipsychotique ou un changement de molécule. Ce sont les benzodiazépines et les anticonvulsivants (phénytoine, acide valproique) qui sont les correcteurs de cet effet. Il est recommandé de ne pas utiliser la carbamazépine en association à la clozapine en raison du risque de neutropénie et d’agranulocytose [22, 23]. Troubles cognitifs Obesity_tab_htm) est indispensable, il est conseillé de diminuer la posologie ou de changer d’antipsychotique (pour ziprazidone, aripiprazole, quétiapine) [4, 22, 23]. Effets métaboliques Anomalie de la régulation glycémique Les AA peuvent entraîner résistance à l’insuline, hyperglycémie, exacerbation d’un diabète de type 1, diabète de type 2, diabète acidocétosique. Génétique et facteurs environnementaux seraient impliqués. Clozapine et olanzapine seraient à plus fort risque [22, 23]. Un changement d’AA est conseillé, bien que peu d’études en montrent l’efficacité. Dyslipidémie Cet effet indésirable des AA est plus particulièrement observé avec la clozapine et l’olanzapine. Peu de cas sont rapportés avec quétiapine, et aucun avec la rispéridone. Lorsque la concentration de LDL est supérieure à 130 mg/dl, un traitement hypocholestérolémiant est à discuter. Le changement d’antipsychotique est conseillé mais ses avantages sont encore à confirmer. Hyperprolactinémie et fonction sexuelle L’hyperprolactinémie est plus fréquente avec les posologies élevées et avec l’halopéridol et la rispéridone. La quétiapine et la clozapine ne modifient pas la prolactine, et celle-ci peut être transitoirement élevée avec l’olanzapine 2. Lorsqu’elle est associée à des troubles des règles et des troubles sexuels comme troubles de l’érection et de l’éjaculation, changement de libido, la diminution de posologie puis le changement de molécule sont conseillés plus que la prescription de bromocriptine. Moins fréquemment, gynécomastie et priapisme peuvent se rencontrer [22, 23]. Une hyperprolactinémie prolongée et une diminution des hormones sexuelles peut entraîner une ostéopénie et une ostéoporose et ne doivent donc pas être négligées [4]. Effets cardiovasculaires Hypotension Bien que les antipsychotiques puissent améliorer les fonctions cognitives, des troubles de la mémoire ou d’autres fonctions cognitives peuvent apparaître sous traitement antipsychotique et plus particulièrement sous AT (liés aux effets anticholinergiques). La lutte contre cet effet générateur de fracture et autres incidents, surtout chez les personnes âgées, passe par la fragmentation des doses et leur diminution, ou par le changement de molécule pour un antipsychotique dénué d’effets antiadrénergiques [22, 23]. La tachycardie due à des effets anticholinergiques peut bénéficier en l’absence d’hypotension de faibles doses de bêtabloquants. Sédation Effet QT et autres C’est un effet indésirable des AT et des AA. Il est lié à l’action sur les systèmes histaminergique, adrénergique et dopaminergique. Il est plus marqué en début de traitement, et une tolérance peut ensuite se développer. Il est conseillé de fractionner les doses et/ou de majorer la prise vespérale. La caféine pourrait être une aide. Quant au modafinil, quelques cas rapportent une toxicité de la clozapine si association [22, 23]. Thioridazine, ziprazidone et sertrindole allongent l’onde QT, et de ce fait augmentent le risque de torsade de pointes et de fibrillation ventriculaire. Il faut alors changer de molécule. La clozapine serait associée à un risque de myocardite [22, 23]. Prise de poids Tous les antipsychotiques, et plus particulièrement les AA, peuvent entraîner une prise de poids. Le risque est plus grand avec la clozapine et l’olanzapine, puis avec la rispéridone et la quétiapine. Le mécanisme en cause n’est pas connu et il n’existe pas encore de facteurs de prédiction. Ce risque peut être majoré en cas d’association de certains antidépresseurs, de lithium, de valproate. Si la prévention (intervention psychologique, activité physique, bonnes habitudes alimentaires ; consulter les conseils de prise en charge de l’obésité sur www.ctfphc.org/Tables/ 14 Effets hématologiques Le risque le plus sévère est celui d’une agranulocytose (0,5 % à 2 %) avec la clozapine. Il est maximum dans les six premiers mois de traitement. Avec les autres antipsychotiques, le cas est très rare. Un taux de leucocytes inférieur à 2 000/mm3 ou une neutropénie inférieure à 1 000/mm3 obligent à arrêter immédiatement la clozapine, et à prendre toutes les mesures nécessaires en cas d’agranulocytose confirmée. Un taux de leucocytes entre 2 000 et 3 000, et une neutropénie entre 1 500 et 1 000/ mm3 doivent faire stopper immédiatement la clozapine, avec une surveillance quotidienne de la formule sanguine et des signes d’infection. Entre 3 000 et 3 500 de leucocytes et des neutrophiles supérieurs à 1 500/mm3, la surveillance hématologique doit être assurée toutes les semaines jusqu’à ce que le taux de globules blancs remonte au dessus de 3 500/mm3. Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 Autres effets secondaires Sialorrhée Effet assez fréquent de la clozapine, il peut imposer de diminuer la posologie. Allergie, effets dermatologiques et photosensibilisation Ils sont rencontrés essentiellement avec les phénothiazines. L’information du patient est importante afin qu’il se protège du soleil. Effets hépatiques La toxicité hépatique des antipsychotiques est faible. On observe parfois une élévation transitoire des enzymes hépatiques, les incidents graves étant extrêmement rares. Effets ophtalmologiques Des dépôts pigmentaires sur la rétine et la cornée, des rétinopathies, un œdème de la cornée, des troubles de l’accommodation et une cataracte ont été décrits avec les antipsychotiques. Sont principalement impliquées la chlorpromazine et la thioridazine. On préconise un examen ophtalmologique tous les deux ans environ lors des traitements au long cours (dix ans par exemple), et la dose maximale de thioridazine est fixée à 800 mg/j par l’APA [2]. La quétiapine est en observation (cataracte animale). Effets urinaires Les antipsychotiques au profil anticholinergique (phénothiazines) ou cholinergique peuvent provoquer rétention et incontinence urinaire. niveau scolaire bas, l’existence de symptômes négatifs ou paranoïdes avec non reconnaissance de la nécessité du traitement. Une amélioration globale de bonne qualité à la sortie de l’hospitalisation (36,9 % d’amélioration à la PANSS versus 23,2 %) va de pair avec une bonne observance future. Cette donnée est indépendante de toutes les autres. Facteurs liés au traitement D’autres facteurs sont liés au traitement. Les patients recevant des AT retard à la sortie d’hospitalisation ont une moins bonne observance que ceux recevant un traitement per os (mais peutêtre la raison de la prescription du retard était-elle déjà liée à la mauvaise observance caractéristique). Par ailleurs, bien qu’aucune relation n’existe entre le choix du traitement initial et l’observance, celle-ci est meilleure chez les patients chez qui l’on a changé l’AT pour un AA que chez ceux à qui l’on maintient l’AT. Une monothérapie est un facteur de bonne observance. Curieusement, dans cette étude, les effets indésirables ne sont pas des facteurs de mauvaise observance de première ligne. Cette notion demeure controversée. Environnement L’environnement familial et médical au sens large a également un rôle. L’alliance thérapeutique et une bonne expérience de l’admission à l’hôpital sont des facteurs majeurs de bonne observance. Un suivi psychosocial et éducatif joue un rôle favorable. Une autre étude récente sur trois ans [43] conclut que parmi 21 facteurs étudiés, l’observance pendant les six mois avant l’étude est le meilleur facteur de prédiction de l’observance future. Un regroupement des facteurs abus de substance illicite, abus récent d’alcool, traitement antérieur par antidépresseur (symptômes dépressifs et anxieux), troubles cognitifs rapportés par le patient et liés au traitement est fortement prédicteur de mauvaise observance. Sécheresse de la bouche et des yeux et constipation Stratégies pour améliorer l’observance médicamenteuse Elles sont liées aux effets adrénergiques et anticholinergiques plus marqués avec les AT. Interventions psychosociales ■ Observance thérapeutique Facteurs de prédiction de l’observance médicamenteuse des patients psychotiques La mauvaise observance thérapeutique est le problème majeur rencontré au cours du traitement des schizophrénies. La prédiction et la surveillance de cette observance médicamenteuse sont primordiales chez le patient traité par antipsychotiques, la mauvaise observance étant liée à un risque de deux à cinq fois plus élevé de rechute et d’hospitalisation. Même de courtes périodes d’arrêt médicamenteux (un à dix jours) sont associées à une augmentation du risque d’hospitalisation, et plus ces périodes sont fréquentes plus le risque s’accroît [41]. Une étude récente chez des patients hospitalisés dans sept hôpitaux psychiatriques allemands [42] montre une grande variabilité dans le pourcentage de bonne observance médicamenteuse observée d’un hôpital à l’autre (66 % à 36,2 %). Facteurs individuels Des facteurs individuels de risque de mauvaise observance ont été mis en évidence, comme l’abus de substances illicites (un des facteurs les plus importants), l’hospitalisation imposée, l’existence de comportements agressifs dans l’histoire de la maladie, un Psychiatrie Différentes techniques sont utilisées, dont la psychoéducation familiale et individuelle, la thérapie cognitivo-comportementale, l’intervention de motivation, un regroupement de ces techniques, etc. Ce type d’interventions semble nécessaire mais peu d’études existent sur leur efficacité sur l’observance, et toutes ces interventions ne sont pas accessibles à tous les patients. Antipsychotiques atypiques per os La meilleure tolérance des AA a permis de penser que leur prescription favoriserait l’observance en améliorant la qualité de vie. En fait, une étude montre que bien que l’observance soit un peu meilleure avec les AA qu’avec les AT, les patients recevant des AA ne prennent quand même pas leur traitement sur un tiers de l’année (110 jours avec AA versus 125 jours avec AT) [41]. Antipsychotiques retard Il semble que l’usage des formes retard améliore l’observance. D’après une revue de six études randomisées, le taux de rechute sur un an est de 42 % avec les antipsychotiques per os versus 27 % avec les formes retard [5]. Ce serait alors la meilleure technique pour améliorer l’observance. La durée d’hospitalisation serait aussi plus courte avec les formes retard. Dans une autre étude au long cours sur deux ans, le taux de rechute serait également plus faible avec ces formes (40,3 % versus 64,7 %). Il semble qu’il faille plus d’un an pour juger des avantages des formes retard. 15 37-295-A-10 ¶ Traitement chimiothérapique des schizophrénies Inconvénients des antipsychotiques retard ■ Références Malgré les résultats favorables sur l’observance, les antipsychotiques retard ne sont pas prescrits aussi souvent qu’ils le devraient. En l’absence d’AA retard, les cliniciens avaient des difficultés à choisir un AT retard et non un AA per os. Côté patient, la peur de la perte du contrôle de son traitement et l’image de patient non observant, la difficulté de gérer les effets indésirables, l’impossibilité d’arrêter le traitement à volonté après l’administration jouent contre ces molécules. Côté clinicien, il semble que les médecins évaluent souvent trop favorablement le caractère bon observant de leur patient. Ils pensent aussi que les patients diront qu’ils prennent mal leur traitement et que les patients doivent apprendre que mauvaise observance signifie rechute. [1] [2] [3] [4] [5] [6] Avantages des antipsychotiques retard sur les per os Premier avantage : aide à l’observance L’injection assure que le traitement est pris, et un rendezvous d’injection manqué mobilise l’équipe soignante. En cas de traitement per os, le clinicien ne peut juger de l’observance sauf en cas de rechute. [7] [8] [9] Deuxième avantage Les injections encouragent le contact régulier avec les soignants. Troisième avantage La voie injectable permet d’éviter le first pass métabolique (inactivation rapide d’une partie de la molécule et production de métabolites parfois inactifs ou toxiques). Elle réduit aussi les fluctuations d’absorption et de biodisponibilité du médicament, et permet d’obtenir des concentrations plasmatiques plus stables, ce qui permet d’utiliser des doses plus faibles. De plus, lorsqu’une injection est manquée, le sevrage est moins brutal que lors de l’arrêt d’une molécule per os. [10] [11] [12] [13] [14] [15] Quatrième avantage Le patient se trouve libéré de l’obligation de prendre quotidiennement son traitement. Enfin, une façon de faire accepter à son patient ce type de traitement serait de lui proposer l’essai d’une dose afin de faire tomber ses appréhensions. [16] [17] Antipsychotiques atypiques retard Les avantages des AA per os se trouvent combinés aux avantages des formes retard. Les AA retard (rispéridone à ce jour) peuvent se prescrire dès que les symptômes aigus sont contrôlés. Ils ne sont pas recommandés en monothérapie chez les patients en crise aiguë en raison de leur délai d’action de trois semaines environ. Ils sont particulièrement indiqués chez les patients dont la mauvaise observance est suspectée, chez les patients abusant de substances illicites, et les patients agressifs et violents. [18] [19] [20] [21] “ [22] À retenir Les antipsychotiques retard améliorent l’observance et diminuent donc le risque de rechute et d’hospitalisation. Ils ont une pharmacocinétique améliorant la biodisponibilité et la stabilité du traitement. Les AA retard devraient faire tomber les réticences vis-à-vis des formes retards en raison de leur meilleure tolérance. 16 [23] [24] Vanelle JM. Traitement chimiothérapique des schizophrénies. EMC (Elsevier Masson SAS, Paris), Psychiatrie, 37-295-A-10, 2000 : 11p. Practice guideline for the treatment of patients with schizophrenia. Am J Psychiatry 2004;161(suppl):1-56. Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for the treatment of schizophrenia and related disorders. Aust N Z J Psychiatry 2005;39:1-30. Canadian Psychiatric Association. Clinical practice guidelines. Treatment of schizophrenia. Can J Psychiatry 2005;50(13suppl1): 7S-57S. Kane JM, Leucht S, Carpenter D, Docherty JP. Expert consensus guideline series. Optimizing pharmacologic treatment of psychotic disorders. Introduction: methods, commentary, and summary. J Clin Psychiatry 2003;64(suppl12):5-19. National Institute for Clinical Excellence. Schizophrenia: core interventions in the treatment and management of schizophrenia in primary and secondary care. Gaskell and the British Psychological Society publishing; 2003 (252p). Lehman AF, Kreyenbuhl J, Buchanan RW, Dickerson FB, Dixon LB, Goldberg R, et al. The Schizophrenia Patient Outcomes research Team (PORT): updated treatment recommendations 2003. Schizophr Bull 2004;30:193-217. Marshall M, Rathbone J. Early intervention for psychosis. Cochrane Database Syst Rev 2006(4):CD004718. Gaebel W, Weinmann S, Sartorius N, Rutz W, McIntyre JS. Schizophrenia practice guidelines: international survey and comparison. Br J Psychiatry 2005;187:248-55. International Statistical Classification of Diseases and Related Health Problems. Geneva: OMS; 2006. Diagnostic and Statistical Manual of Mental Disorders. Text Revision. American Psychiatric Association; 2000. Liddle PF. The symptoms of chronic schizophrenia. A re-examination of the positive-negative dichotomy. Br J Psychiatry 1987;151:145-51. Lindenmayer JP, Bernstein-Hyman R, Grochowski S. Five factors model of schizophrenia: initial validation. J Nerv Ment Dis 1994;182: 631-8. Ferreri M, Rouillon F, Nuss P, Bazin N, Farah S, Djaballah K, et al. De quelles informations les patients souffrant de schizophrénie disposentils sur leur maladie et leur traitement. Encephale 2000;26:30-8. Rocamora JF, Benadhira R, Saba G, Stamatadis L, Kalalaou K, Dumortier G, et al. Annonce du diagnostic de schizophrénie au sein d’un service de psychiatrie de secteur. Encephale 2005;31:449-55. Jones PB, Barnes TR, Davies L, Dunn G, Lloyd H, Hayhurst KP, et al. Randomized controlled trial of the effect on quality of life if secondvs-first-generation antipsychotic drugs in schizophrenia: cost utility of the latest antipsychotic drugs in schizophrenia study (CUtLASS 1). Arch Gen Psychiatry 2006;63:1079-87. Barbui C, Nose M, Mazzi MA, Thornicroft G, ScheneA, Becker T, et al. Persistence with polypharmacy and excessive dosing in patients with schizophrenia treated in four European countries. Int Clin Psychopharmacol 2006;21:355-62. Cassano GB, Fagiolini A, Lattanzi L, Monteleone P, Niolu C, Sacchetti E, et al. Aripiprazole in the treatment of schizophrenia. Clin Drug Invest 2007;27:1-3. Yuzda MS. Combination antipsychotics: what is the evidence? J Inform Pharmacother 2000;2:300-5. Correll CU, Carlson HE. Endocrine and metabolic adverse effects of psychotropic medications in children and adolescents. J Am Acad Child Adolesc Psychiatry 2006;45:771-91. Harrington M, Lelliot P, Paton C, Okocha C, Duffett R, Sensky T. The results of a multi-centre audit of the prescribing of antipsychotic drugs for in-patients in the UK. Psychiatr Bull 2002;26:414-8. Falkai P, Wobrock T, Lieberman J, Glenthoj B, Gattaz WF, Möller HJ. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for biological Treatment of Schizophrenia, Part 1: Acute treatment of schizophrenia. World J Biol Psychiatry 2005;6:132-91. Falkai P, Wobrock T, Lieberman J, Glenthoj B, Gattaz WF, Möller HJ. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for biological Treatment of Schizophrenia, Part 2: Longterm treatment of schizophrenia. World J Biol Psychiatry 2006;7:5-40. Roesch-Ely D, Gohring K, Gruschka P, Kaiser S, Pfuller U, Burlon M, et al. Pergolide as adjuvant therapy to amisulpride in the treatment of negative and depressive symptoms in schizophrenia. Pharmacopsychiatry 2006;39:115-6. Psychiatrie Traitement chimiothérapique des schizophrénies ¶ 37-295-A-10 [25] McEvoy JP, Lieberman JA, Stroup TS, Davis SM, Meltzer HY, Rosenheck RA, et al. Effectiveness of clozapine versus olanzapine, quetiapine, and risperidone in patients with chronic schizophrenia who did not respond to prior atypical antipsychotic treatment. Am J Psychiatry 2006;163:563-5. [26] Lewis SW, Barnes TR, Davies L, Murray RM, Dunn G, Hayhurst KP, et al. Randomized controlled trial of effect of prescriptioàn of clozapine versus other second-generation antipsychotic drugs in resistant schizophrenia. Schizophr Bull 2006;32:715-23. [27] Mouaffak F, Tranulis C, Gourevitch R, Poirier MF, Douki S, Olie JP, et al. Augmentation strategies of clozapine with antipsychotics in the treatment of ultraresistant schizophrenia. Clin Neuropharmacol 2006; 29:28-33. [28] Chong SA, Remington G. Clozapine augmentation: safety and efficacy. Schizophr Bull 2000;26:421-40. [29] Ucok A, Cakr S. Electroconvulsive therapy in first-episode schizophrenia. J ECT 2006;22:38-42. [30] Suzuki K, Awata S, Tanako T, Ebina Y, Shindo T, Harada N, et al. Adjusting the frequency of continuation and maintenance electroconvulsive therapy to prevent relapse of catatonic schizophrenia in middle-aged and elderly patients who are relapse-prone. Clin Neurosci 2006;60:486-92. [31] Large CH, Webster EL, Goff DC. The potential role of lamotrigine in schizophrenia. Psychopharmacology (Berl) 2005;181:415-36. [32] Tuominen HJ, Tiihonen J, Wahlbeck K. Glutamatergic drugs for schizophrenia. Cochrane Database Syst Rev 2006(2):CD003730. [33] Taylor M, Chaudhry I, Cross M, McDonald E, Miller P, Pilowsky L, et al. Towards consensus in the long-term management of relapse prevention in schizophrenia. Hum Psychopharmacol 2005;20:175-81. [34] Seeman MV. Gender differences in the prescribing of antipsychotic drugs. Am J Psychiatry 2004;161:1324-33. [35] Kelly DL. Treatment considerations in women with schizophrenia. J Womens Health 2006;15:1132-40. [36] Trixler M, Gati A, Fekete S, Tenyi T. Use of antipsychotics in the management of schizophrenia during pregnancy. Drugs 2005;65:1193-206. [37] Masi G, Mucci M, Pari C. Children with schizophrenia; clinical picture and pharmacological treatment. CNS Drugs 2006;20:841-66. [38] Shaw P, Sporn A, Gogtay N, Overman GP, Greenstein D, Gochman P, et al. Childhood-onset schizophrenia; A double-blind, randomized clozapine-olanzapine comparison. Arch Gen Psychiatry 2006;63: 721-30. [39] Correll CU, Frederickson AM, Kane JM, Manu P. Does antipsychotic polypharmacy increase the risk for metabolic syndrome? Schizophr Res 2007;89:91-100. [40] Alexopoulos GS, Streim J, Carpenter D, Docherty JP. Using antipsychotic agents in older patients. J Clin Psychiatry 2004; 65(suppl2):5-99. [41] Kane JM. Review of treatments that can ameliorate non adherence in patients with schizophrenia. J Clin Psychiatry 2006;67(suppl5):9-14. [42] Janssen B, Gaebel W, Haerter M, Komaharadi F, Lindel B, Weinmann S. Evaluation of factors influencing medication compliance in inpatient treatment of psychotic disorders. Psychopharmacology (Berl) 2006;187:229-36. [43] Ascher-Svanum H, Zhu B, Faries D, Lacro JP, Dolder CR. A prospective study of risk factors for non adherence with antipsychotic medication in the treatment of schizophrenia. J Clin Psychiatry 2006;67:1114-<23. P. Vandel, Professeur des Universités, praticien hospitalier ([email protected]). E. Haffen, Maître de conférences des Universités, praticien hospitalier. D. Sechter, Professeur des Universités, praticien hospitalier, chef de service. Service de psychiatrie de l’adulte, Centre hospitalo-universitaire, 2, place Saint-Jacques, 25030 Besançon cedex, France. Toute référence à cet article doit porter la mention : Vandel P., Haffen E., Sechter D. Traitement chimiothérapique des schizophrénies. EMC (Elsevier Masson SAS, Paris), Psychiatrie, 37-295-A-10, 2008. Disponibles sur www.emc-consulte.com Arbres décisionnels Psychiatrie Iconographies supplémentaires Vidéos / Animations Documents légaux Information au patient Informations supplémentaires Autoévaluations 17