UE10 Do Van Lan neuropharmacologie

- 1 -
UE 10- Neurologie
Dr Do-Van-Lanh
Date : 28/02/2017 Promo : D1 2016/2017
Ronéistes :
David RAYBAUD
Anthony MALLET
Neuropharmacologie : dépression, maladie d’Alzheimer,
maladie de Parkinson
I. La dépression
1) Généralités
2) Les anti-dépresseurs
A. Tricycliques imipraminiques (AD tricycliques)
B. ISRS = Inhibiteurs Spécifiques de la Recapture de la Sérotonine
C. Inhibiteurs mixtes (IRSNa)
D. Inhibiteurs de la MonoAmine Oxydase (IMAO)
II. La maladie de Parkinson
1) Généralités
2) Les médicaments anti-parkinsoniens
A. La Dopathérapie
B. Agonistes dopaminergiques
C. Les Anticholinergiques
D. Les IMAO-B = Inhibiteurs de la Monoamine Oxydase de type B.
E. Les ICOM-T
III. La maladie d’Alzheimer
1) Généralités
2) Traitements
A. Les Anticholinesterasiques (IAChE) de 2e génération: +connus
B. Antagoniste des Récepteurs NMDA
C. Autres traitements
D. Piste des futurs traitements

- 2 -
I. La dépression
1) Généralités
Définition : Pour être qualifié de dépressif, il faut (sur 15 jours) avoir en plus de l’humeur dépressive, perte
d’intérêt, au moins 4 des symptômes suivants : amaigrissement, perte d’appétit, troubles du sommeil,
asthénie, anxiété, difficulté à la concentration, idées suicidaires et troubles psychomoteurs.
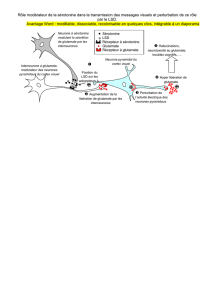
Traitement : Il faudra favoriser la transmission de monoamines cérébrales (noradrénaline Nad et en
particulier sérotonine 5HT) car dans la dépression, on a une chute de la quantité de certains
neurotransmetteurs.
Les traitements font effet au minimum au bout de 15 jours, et peuvent ne pas être efficaces chez certains. Ils
améliorent l’humeur dépressive pathologique (thymo–analeptiques).
On ne peut donc juger de l’efficacité d’un traitement au bout d’un délai de 2 à 3 semaines, avec une
phase de consolidation qui suit de 4 à 6 mois pour éviter le risque de rechute.
Il y a ensuite un arrêt progressif du traitement afin d’éviter un phénomène de sevrage.
IMPORTANT : Les classes de médicaments présentés sont à savoir et les noms aussi !! Au moins les DCI !!
Elle a dit qu’il y aura 2 QCM sur les Antidépresseurs / 2 QCM sur les Anti-Parkinsoniens / 2 QCM sur les
traitements contre la maladie d’Alzheimer.
Classification / 4 classes d’antidépresseurs :
- Antidépresseurs tricycliques (3 cycles sur la molécule)
- Inhibiteurs de la monoamine oxydase (IMAO) non sélectifs et sélectifs
- Inhibiteurs sélectifs de recapture de la sérotonine (ISRS)
- Inhibiteurs de recapture de la sérotonine et Nad (non sélectifs) = Inhibiteurs mixtes ;
Les AD tricycliques : Les AD les plus anciens, ce sont aussi ceux qui ont le plus d’effet secondaires. En
effet cela est dû à leur faible sélectivité et leur fixation irréversible, on a ainsi une forte cardiotoxicité
(blocage récepteurs muscariniques et alpha adrénergiques.
Les IMAO (inhibiteurs de la monoamine oxydase) : sélectifs ou non sélectifs. Effets secondaires ++. Il y a
une fenêtre à respecter quand on les switch à un autre AD. Ils agissent en inhibant la dégradation de la
noradrénaline.

- 3 -
Les ISRS : moins d’effets secondaires car + selectifs !
Inhibiteurs mixtes IRSNa
2) Les antidépresseurs
A. Tricycliques imipraminiques (AD tricycliques)
AD tricycliques : (à retenir) !
• Absorption : bonne dans le duodénum +++, mais faible biodisponibilité dans l’ensemble
• Distribution : forte liaison protéique plasmatique dont l’albumine ➔ attention interactions
• Métabolisme
• Elimination urinaire
Indications : état dépressif de toutes natures, ce fut le traitement de référence autrefois mais aujourd’hui il
est moins utilisé en raison de ses nombreux effet secondaires.
Ils vont agir en bloquant de manière non sélective les récepteurs muscariniques, alpha adrénergiques
et histaminiques.
Effets secondaires atropiniques = anticholinergiques !!! ce qui veut dire : sécheresse de la bouche,
troubles de la vision, constipation, rétention urinaire, hypotension orthostatique, tachycardie et plus rarement
prise de poids.
Contre-indications :
Troubles de la conduction cardiaque, glaucome, adénome prostatique,
Infarctus récent, association aux IMAO non sélectifs, grossesse/allaitement
Bien retenir surdosage → cardiotoxicité (arythmie).
Interactions :
IMAO non sélectifs (intervalle libre à respecter), sultopride BARNETIL.
Précautions d’emploi :
Surveillance chez sujet âgé (hypotension orthostatique, constipation), les Épileptiques, insuffisance rénale
(élimination urinaire) ou hépatique.
Prise matin ou soir selon effet psychotonique/sédatif qu’on recherche.
Certains AD (notamment psychotoniques) peuvent lever l’inhibition et entraîner un passage à l’acte
(suicide).
Les apparentés aux tricycliques (en vert) sont eux dépourvus de toxicités cardiaque et d’effets
atropiniques.
DCI à connaître désolé… ne pas apprendre posologie et particularités

- 4 -
Ronéo de l’année dernière :
Ceux qui sont souvent utilisés :
- LAROXYL (Amitriptyline, AD tricyclique, sédatif anxiolytique) ;
- STABLON (Tianeptine, AD intermédiaire, sédatif et psychotonique) ;
- ANAFRANIL
Le choix se fait selon le type de dépression (anxieuse, avec inhibition, risque
suicidaire, etc) la typologie des patients (âge, cardiaque, etc), selon que l’on soit
hospitalisé ou en ambulatoire.
Les tricycliques sont à éviter chez la personne âgée et le patient cardiaque.
En ville, suivi et médication PO.
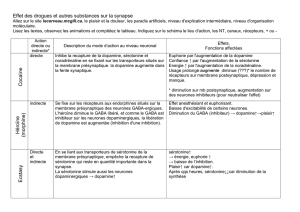
B. ISRS = Inhibiteurs Spécifiques de la Recapture de la Sérotonine
Ce sont les plus prescrits, car ils présentent moins d’effets secondaires que les autres catégories. Les
inhibiteurs 5HT3 de la sérotonine (= ISRS) sont aussi efficaces et n’ont aucune toxicité cardiaque.
Effets secondaires (plutôt faible) : nausées, vomissements, diarhées, troubles du sommeil.
ATTENTION cependant au syndrome sérotoninergique (en cas de surdosage) :
→ au niveau digestif : diarhées
→ au niveau moteur : rigidité myoclonique, tremblements
→ au niveau végétatif : tachycardie, sueurs, hypo/hypertension
→ au niveau psychique : agitation, confusion, coma voire décès.
Info : le syndrome sérotoninergique présente des symptômes variés et inconstants d’où la difficulté de
diagnostic, importance de l’anamnèse ++.
Interactions : IMAO (les IMAO interagissent
souvent), triptans – NARAMIG,
ZOMIG -, alcool, Antiépileptiques
(TEGRETOL et DEPAKINE),
benzodiazépines
(Par inhibition des enzymes hépatiques),
clomipramine et buspirone (potentialise le
Syndrome sérotoninergique).
Connaître au moins les 2 premiers

- 5 -
C. Inhibiteurs mixtes (IRSNa)
Ils agissent à la fois sur la recapture de la noradrénaline et de la sérotonine. Ils ont moins d’effets
secondaires que les imipraminiques, mais ont les mêmes interactions que les ISRS.
Celui qu’on utilise le plus dans cette classe c’est l’EFFEXOR car il a un délai d’actioncourt (< 2
semaines), pas d’effet secondaire cardiaque, moins d’effet secondairesérotoninergique.
D. Inhibiteurs de la MonoAmine Oxydase (IMAO)
Nombreuses interactions et effets indésirables +++
Ils inhibent la dégradation de la noradrénaline, de la sérotonine et de la dopamine.
Plutôt utilisés en deuxième intention !
→ IMAO non sélectifs : nombreuses interactions et effets indésirables (MARSILID = Iproniazine)
→ IMAO sélectifs de type A : inhibent ++ la dégradation de la noradrénaline et de la sérotonine. Ils ont
moins d’interactions médicamenteuses et alimentaire, cependant ils peuvent entraîner tachycardie ou
hypotension (HUMORYL = toloxatone / MOCLAMINE = moclobémine).
Rajout : Elle en a parlé l’année dernière aussi, son explication cette année étant très flou on a remis celle
de l’année dernière pour mieux comprendre :
Les IMAO de type B sont un peu plus sélectifs, ils inhibent ++ dégradation dopamine.
Comme IMAO irréversible, on a le MARSILID qui n’est d’ailleurs pratiquement plus utilisé (qu’en cas de
dépression résistante). Il peut induire des hépatites qui sont parfois mortelles.
Dans ce cas, les neuromédiateurs (noradré, sérotonine et dopamine) ne vont plus êtredégradés car l’enzyme
est bloquée sur toute la chaine jusqu’à ce qu’il y ait une nouvelle synthèse. Ce qui pourra provoquer du
coup des risques de crise hypertensive; on peut avoir aussi des risques d’hémorragie cérébrale si il y a une
ingestion d’aliments qui apportent certaines amines ou de la tyramine qu’on trouve dans certains fromages
++ ou dans la bière.
Cette tyramine déplace la noradrénaline de ses sites de stockage et va la libérer dans la synapse et entrainer
des crises hypertensives ! Même raisonnement pour la sérotonine, donc elle entrainera un syndrome
sérotoninergique.
Donc ce qu’il y a à retenir avec les IMAO irréversibles, c’est qu’on a des risques de crises hypertensives et
d’hémorragies cérébrales avec les aliments qui contiennent de la tyramine donc risque d’effet fromage ++
Mais qu’est-ce que l’effet fromage ??? Non ça ne consiste pas à atteindre un état second psychique
intense par l’ingestion massive de fromage.
L’effet fromage est dû et à la capacité des anti-dépresseurs à bloquer l’enzyme MAO et aux niveaux
élevés de l’acide aminé tyramine dans le fromage, la bière ou le vin. Normalement, la tyramine est
métabolisée et inactivée par la MAO dans le corps et le cerveau. Lors de la prise d’antidépresseurs, la
MAO est inhibée, la consommation de ces aliments devient nocive et occasionne des troubles de la tension
artérielle..
(Fin du rajout année dernière)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%