Partie_3_-_activite_..

!"#$%&'()*)+),(-.'%$&%/0)(&)-&1'1/."%2%()3(-)2/41.54(-)/'6#0%75(-))))))))))))8(9:;'()<=>?@<=>*)
)
>)
!ABCDEFG)*)+),GH!FDCEDIJ)GE)HEGFGI!ADKDG),GH)KI8G!L8GH)IFMBJDNLGH)
Partie'3/3':'Chiralité'et'activité'optique'
)
I. CHIRALITE'
Définition)+)L0()2/41.54()(-&)3%&()chirale'4/'-75O(44()0O(-&)pas'superposable'P/5)$#-)%3(0&%75(Q''à'son'image'par'rapport'à'un'
miroir'plan.)L0()2/41.54()75%)0O(-&)$#-)."%'#4()(-&)3%&()achiraleR)
'
II. MANIFESTATION'EXPERIMENTALE'DE'LA'CHIRALITE':'L’ACTIVITE'OPTIQUE'
)
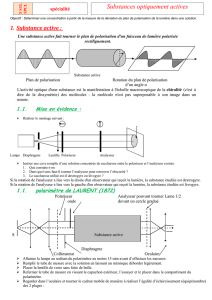
1. Notion'd’activité'optique'
L0() 452%:'() 2/0/."'/2#&%75() (-&) 50() /03()
14(.&'/2#601&%75() 75%) -() $'/$#6()+) (44() (-&) ./0-&%&51() 3O50)
champ' électrique)2#&1'%#4%-1) $#') 4() ;(.&(5')E!)(&) 50) champ'
magnétique)2#&1'%#4%-1) $#') 4() ;(.&(5')B!S) .(-) 3(5T) ;(.&(5'-)
-/0&) $('$(03%.54#%'(-) U) 4#) 3%'(.&%/0)3() $'/$#6#&%/0) 3() 4#)
452%:'(V)2#&1'%#4%-1()$#')4()'#W/0)452%0(5TR))
,#0-)50()452%:'()0#&5'(44(V)4();(.&(5')E!)P.(45%)#575(4)4OX%4)(-&)
-(0-%Y4(Q)$'(03)&/5&(-)4(-)3%'(.&%/0-)#5&/5')3()4#)3%'(.&%/0)3()$'/$#6#&%/0R))
,#0-)50()lumière'polarisée'rectilignementV)4#)3%'(.&%/0)3()E!)$#')'#$$/'&)U)4#)3%'(.&%/0)3()$'/$#6#&%/0)(-&)31&('2%01(R))
Le'plan'formé'par'la'direction'de'𝐄!'et'le'rayon'lumineux'est'appelé'plan'de'polarisation.'
C/5')$/4#'%-(')4#)452%:'(V)/0)9#%&)$#--(')4#)452%:'()U)&'#;('-)50)$/4#'%-(5')+)4()$/4#'%-(5')0()4#%--()$#--(')75()4(-)/03(-)$/4#'%-1(-)
-(4/0)50).('&#%0)$4#0R))
)
G0)>Z><V)[%/&)#)31./5;('&)75O50() 2/41.54()."%'#4()$/--:3()4#)$'/$'%1&1)3()31;%(')3O50)#064()\)le' plan' de' polarisation)3]50()
452%:'()%0.%3(0&()$/4#'%-1()+)/0)3%&)75().(-)2/41.54(-)/0&)50)pouvoir'rotatoire'αR))
)
Remarque)+)!()$"10/2:0()0O(-&)pas'perceptible)U)4OX%4)05R)

!"#$%&'()*)+),(-.'%$&%/0)(&)-&1'1/."%2%()3(-)2/41.54(-)/'6#0%75(-))))))))))))8(9:;'()<=>?@<=>*)
)
<)
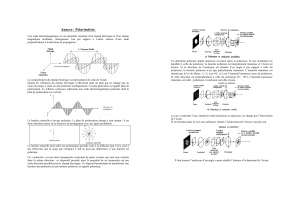
N5#03)/0)(0;/%()50()452%:'()$/4#'%-1()-5')50)1."#0&%44/0)./0&(0#0&)50()2/41.54()."%'#4(V)4()$4#0)3()$/4#'%-#&%/0)3()4#)452%:'()
$(5&)&/5'0(')P35)$/%0&)3();5()3()4O/Y-(';#&(5'Q)+)
! ;('-)4#)droite' +)4#) 2/41.54() (-&)#4/'-)3%&() dextrogyre)(&)-/0)$/5;/%')'/&#&/%'()(-&)positifR)H/0)0/2) $(5&)^&'()$'1.131)
3O50)P_QR)Exemple':'la'(+)-alanine'est'dextrogyre.)
! ;('-)4#)gauche'P./22()-5')4()-."12#).%@3(--5-Q'+)4#)2/41.54()1�&)#4/'-)#$$(41()lévogyre)(&)-/0)$/5;/%')'/&#&/%'()(-&)
négatifR)H/0)0/2)$(5&)^&'()$'1.131)3O50)P@QR)Exemple':'le'(-)-2-bromobutane'est'levogyre.'
Attention'+) D4) (-&) %2$/--%Y4() 3() $'1;/%') -%) 50() 2/41.54() ."%'#4() -('#) 3(T&'/6W'() /5) 41;/6W'(R) Il' n’y' a' pas' de' lien' entre'
configuration'et'pouvoir'rotatoire.'
)
2. Loi'de'Biot'
#R G0/0.1)
C/5') 50() -5Y-�.() ."%'#4() 3/001(V) 4() $/5;/%') '/&#&/%'() 31$(03) 3(-) ./03%&%/0-) (T$1'%2(0(-)+) ./0.(0&'#&%/0) (0) -5Y-�.()
."%'#4(V)4/065(5') 3() 4#) .5;(V) &(2$1'#&5'(V)0#&5'() 35)-/4;#0&V)4/065(5')3O/03()3() 4#) 452%:'()5&%4%-1(R)[(#5./5$) 3() -5Y-�.()
-5%;(0&)4#)loi'de'Biot'+)4()$/5;/%')'/&#&/%'()α'est'proportionnel'à'la'concentration'c'et'à'la'longueur'l'de'la'cuve':')
𝛂=[𝛂]𝛌
𝛉.𝓵.𝐜'
B;(.)+))
• \)4()$/5;/%')'/&#&/%'()3()4#)-/45&%/0)P(0)`Q)
• [α]!
!))P(0)°.32@>R6@>R.2aQ'4()pouvoir'rotatoire'spécifique'de'l’espèce'chirale'considérée'à'la'longueur'd’onde'λ'et'à'la'
température'θ'Pb=)$/5')50()2/41.54()3(T&'/6W'(V)c=)$/5')50()2/41.54()41;/6W'(QR)
G0)6101'#4V)4(-);#4(5'-)3()$/5;/%')'/&#&/%'()-$1.%9%75()-/0&)&#Y541(-)U)<=`!)(&)$/5')4#)4/065(5')3O/03()./''(-$/03#0&)U)4#)'#%(),)
35)-/3%52V).O(-&)U)3%'()*Zd)02)P/0)0/&([α]!
!"QR)
• !)4#)4/065(5')3()4#).5;()P(0)32Q)
• c)4#)./0.(0&'#&%/0)3()4O(-$:.()P(0)6R.2@ae6R28@>Q)
'
Remarque':'pour'des'solution'usuelles,'le'pouvoir'rotatoire'est'compris'entre'-180°'et'+180°.'
YR B33%&%;%&1)3(-)$/5;/%'-)'/&#&/%'(-)
,#0-) 4() .#-) 3() $45-%(5'-) -5Y-�.(-) /$&%75(2(0&) #.&%;(-V) %4) W) #) #33%&%;%&1) 3(-) $/5;/%'-) '/&#&/%'(-)S) 4() $/5;/%') '/&#&/%'() 3()
4O1."#0&%44/0)#)#4/'-)$/5')(T$'(--%/0)+))
α=α!!
!.!.c!!
!"#!$%!!"#!!"#è%!"!!"#$%&'(!!
)
3. Activité'optique'des'molécules'chirales'
E/5&(-)4(-)2/41.54(-)."%'#4(-)$'1-(0&(0&)50)$/5;/%')'/&#&/%'(R)
Deux'énantiomères'ont'des'pouvoirs'rotatoires'spécifiques'opposés'(donc'l’un'est'lévogyre,'l’autre'dextrogyre).'
Exemple':'(S)-alanine'(acide'aminé'naturel)':' '
α
[ ]
D
20 = +32, 3°.dm−1.g−1.cm3
(notée'(+)-alanine,'dextrogyre)'
'(R)-alanine':' '
α
[ ]
D
20 =−32, 3°.dm−1.g−1.cm3
(notée'(-)-alanine,'lévogyre)'
Conséquence'1':)Pouvoir'rotatoire'd’un'racémique)
H/%&)50)'#.12%75(V)214#06()175%2/4#%'()3()3(5T)10#0&%/2:'(-)B)(&)[R),O#$':-)4#)4/%)3()[%/&V)4()$/5;/%')'/&#&/%'()3()4#)-/45&%/0)
(-&)α=α!!
!.!.c!+α!!
!.!.c!R) I'V)B)(&)[)1�&)10#0&%/2:'(-V)/0)#) α!!
!.=−α!!
!)(&)4() 214#06() 1�&) 175%2/4#%'(V) /0) #)
!Be