File - L2 Bichat 2012-2013

Ronéo 2 Page 1
UE6 Hématologie
DPr Da Costa
Le 12/10/12 à 8h30
Ronéotypeuse : Shirley Odouard
Ronéolectrice : Natacha Moutard
COURS n°2
L’HEMATOPOIESE

Ronéo 2 Page 2
Hématologie – Hématopoïèse
Plan
I. Introduction : lien entre les cellules du sang et la moelle
1. Les différentes cellules sanguines
2. La durée de vie des cellules sanguines
3. La quantité des cellules sanguines
II. Ontogenèse
III. Les différents compartiments médullaires
4. Les cellules souche hématopoietiques
5. Les progéniteurs
6. Les précurseurs medullaires
IV. Détails lignée par lignée des différentes cellules hématopoïétique
1. La lignée erythroide
2. La megacaryopoiese
3. La lignée monocytaire et granuleuse
4. La lymphopoiese
V. Régulation de l’hématopoïèse
1. Le stroma
2. Le rôle du stroma dans la régulation
3. Les cytokines ou facteurs de croissance
VI. Exploration de l’hématopoïèse (exemple de moelles normales et pathologiques)
1. le myélogramme et la biospsie ostéo medullaire
2. Anomalies du myélogramme : généralités

Ronéo 2 Page 3
Petit discours de début du cours.
« Vous avez 6 cours magistraux, à connaitre avant les séances d’APP. En ce concerne les
cours, il y a une séance de révision à la fin des APP pour éclaircir certains points, et mieux
cibler ce que l’on vous demande pour l’examen..
Il y a une séance « formation » qui est obligatoire. Les séances en elles-mêmes sont aussi
obligatoires et changer de groupe est interdit.
L’évaluation de la séance se fait sur la participation et non sur la présence : le but même de
ces séances est donc de participer. Cette note comptera pour la note finale. Il faut vraiment
travailler ces APP et les animer de manière à ce que cet enseignement soit interactif.
Un poly d’hémostase sera bientôt disponible (voir la scolarité….). »
Alors ce cours fait 80 diapos, d’où les 22 pages (oui dur…). Je remercie Mme Da Costa
d’avoir relu le ronéo et de l’avoir corriger.
Je vous épargne la Kikou dédicace traditionnelle, j’arrive à 22 pages piles ;)
Bon courage à tous.
I Introduction : lien entre les cellules du sang et la moelle osseuse.
1) Les différentes cellules du sang, globules blancs, globules rouges, et plaquettes.
Les globules blancs ou leucocytes sont constitués de :
a) Les polynucléaires :
- Neutrophiles, qui vont permettre la défense de l’organisme contre les bactéries
- Eosinophiles, qui vont permettre la défense de l’organisme contre les parasites et
les allergies
- Les basophiles qui jouent un rôle dans l’inflammation et l’allergie.
Dans tous les cas ces cellules sont indispensables à la défense de notre organisme contre les
agents infectieux, les corps étrangers, les allergènes….
b) Les lymphocytes :
- Natural Killer
- Lymphocytes T (ou cellules T). Ces deux premiers types servent à l’immunité
cellulaire
- Les lymphocytes B, pour l’immunité humorale.
c) Les monocytes : pour la défense de l’organisme, la surveillance immunitaire (ce sont
les précurseurs des macrophages).

Ronéo 2 Page 4
d) Les érythrocytes ou hématies ou globules rouges véhiculent l’oxygène aux tissus et
contiennent une protéine majoritaire qui transporte cet oxygène, l’hémoglobine
e) Les plaquettes, qui interviennent dans la coagulation
1) La durée de vie des cellules sanguines
- Polynucléaires neutrophiles : 6 à 8h (<3jours dans le sang)
- Polynucléaires éosinophiles : 8 à 12h(<10jours dans le sang)
- Polynucléaires basophiles : inconnue
- Monocytes : 2jours environ dans le sang, mais il faut savoir que leur durée de vie
est plus longue lorsqu’ils deviennent des macrophages dans les tissus.
- Lymphocytes : ils ont une durée de vie et des fonctions hétérogènes car des
lymphocytes peuvent par exemple avoir des fonctions « mémoire » et dans ce cas
là leur durée de vie peut s’allonger à plusieurs années (que ce soit B, T ou les NK).
- Erythrocytes : 120jours
- Plaquettes : 8 à 10jours
2) La quantité des cellules du sang (A SAVOIR !).
Les neutrophiles : 1.7 à 7.109/L
Les éosinophiles : 0,05 à 0,5.109/L
Les basophiles : < 0,1.109/L
Les érythrocytes : 4 à 6.1012/L (attention à la puissance 12 !)
Les plaquettes : 150 à 450.109/L
Les monocytes : 0,1 à 1.109/L
Les lymphocytes : (tout confondu) 1 à 4.109/L
Un mécanisme physiologique doit permettre de produire l’ensemble des cellules sanguines,
cela implique:
- une capacité de prolifération et de renouvellement (quantitatif)
- une capacité de diversification (qualitatif = différenciation)
- une capacité de régulation : équilibre/homéostasie
Ceci est rendu possible par l’hématopoïèse qui répond à ces besoins aussi bien
qualitativement que quantitativement.
En effet ces cellules ont des morphologies, des fonctions, des quantités et des durées de
survies différentes et surtout ce sont des cellules matures incapables de se renouveler. . Il faut
qu’il existe un mécanisme physiologique capable d’assurer toute cette diversité. C’est
l’hématopoïèse.

Ronéo 2 Page 5
L’hématopoïèse : C’est l’ensemble des mécanismes qui assurent la production constante et
régulée des différentes cellules sanguines. La production est énorme et se doit d’être régulée
notamment par des facteurs de croissance qui sont produits par le microenvironnement.
On distingue un compartiment très minoritaire : ce sont les CSH (cellules souches
hématopoïétiques) qui jouent le rôle de réservoir.
Production constante Nbre / Durée de vie Production/j
globules rouges: 20.1012 / 120 j 200.109
PN Neutrophiles 0,5. 1012 / 24 h 50. 109
Plaquettes 1,0. 1012 / 7 j 100. 109
C’est une production régulée par :
- les facteurs de croissance et le microenvironnement
- l’existence d’un compartiment très minoritaire de cellules souches hématopoïétiques
capables de générer la totalité des éléments du sang.
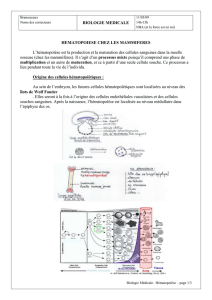
II. Ontogenèse
Définition : C’est l’étude de la croissance et du développement d’un individu (ou d’un tissu)
depuis la fécondation de l’œuf jusqu’à l’âge adulte.
On remarque deux vagues successives de production de Cellules Souches Hématopoïétiques
(CSH) :
–l’hématopoïèse primitive dans le sac vitellin (site extra-embryonnaire) à J8 qui produit des
CSH.
–l’hématopoïèse définitive dans l’AGM (site intra-embryonnaire : Aorte-gonado-
mésonéphros qui représente l’aorte, l’ébauche des crêtes génitales et l’ébauche du rein). Ce
sont les CSH qui colonisent ensuite les organes hématopoïétiques (foie, rate, thymus).
Le placenta sera aussi envahi et pourra produire un grand nombre de CSH.
Topo chronologique : à J9 (donc à partir du sac vitellin) il y a une colonisation du mésoderme,
puis progressivement une colonisation du foie et de la rate au 2e mois.
Au 4e mois la moelle osseuse est colonisée principalement à partir des CSH du foie.
Au final la moelle osseuse prendra totalement le relais vers 6 mois et est l’unique organe
hématopoïétique à l’âge adulte.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%