Comparaison entre chambre implantable et cathéter central inséré

1
Chambre implantable versus cathéter
central inséré par voie périphérique pour
l’administration d’une chimiothérapie
adjuvante dans le cancer du sein : étude
rétrospective de 448 patientes et
lancement d’une étude prospective
Mémoire de DES d’Oncologie option Radiothérapie
Laureline LEFEBVRE sous la direction du Dr Florian Clatot
Soutenu le 5 Juin 2015

2
ETUDE RETROSPECTIVE
I. Introduction ....................................................................................................................... 3
1) Epidémiologie et place de la chimiothérapie adjuvante pour la prise en
charge du cancer du sein localisé ............................................................................. 3
2) Intérêt des Cathéter à Chambre Implantable (CCI) et des Cathéter
insérés par voir périphérique (PICC) pour l’administration de
chimiothérapie ................................................................................................................. 4
a) Avantages et inconvénients du CCI .................................................................... 4
b) Avantages et inconvénients du PICC ................................................................. 5
3) Etats actuels des connaissances sur les CCI et les PICC dans
l’administration de chimiothérapie chez des patients atteints de cancers
non hématologiques ....................................................................................................... 5
II. Patients et méthodes .................................................................................................... 7
1) Méthode ............................................................................................................................. 7
2) Objectif principal ........................................................................................................ 8
3) Objectif secondaire .................................................................................................... 8
4) Description des dispositifs ...................................................................................... 9
a) Description des CCI et des procédures de pose et de retrait ..................... 9
b) Description des PICC et des procédures de pose et de retrait .................. 9
5) Traitements prophylactiques ................................................................................ 10
6) Analyse statistique ................................................................................................... 10
III. Résultats ....................................................................................................................... 10
1) Description de la population incluse ................................................................. 10
2) Objectif principal ...................................................................................................... 12
3) Objectif secondaire .................................................................................................. 13
IV. Discussion .................................................................................................................... 16
1) Interprétation des résultats .................................................................................. 16
2) Limites de cette étude ............................................................................................. 16
3) Comparaison aux données de la littérature .................................................... 17
V. Conclusion ..................................................................................................................... 22
ETUDE PROSPECTIVE EPIC
I. Protocole ............................................................................................... 23
II. Autorisations administratives et financements ..................................... 23
III. Etat d’avancement .............................................................................. 23
IV. Références .......................................................................................... 24
ANNEXES

3
ETUDE RETROSPECTIVE
I. Introduction
1) Epidémiologie et place de la chimiothérapie adjuvante pour la prise en
charge du cancer du sein localisé :
En Europe, le cancer du sein est le plus fréquent avec une incidence en
2012 de 464 000 cas, devant le cancer colorectal (447 000 cas) et le cancer
de la prostate (417 000 cas). Il est la troisième cause de décès par cancer
(131 000 décès) après le cancer du poumon (353 000 décès) et le cancer
colorectal (215 000 décès) (1).
En France métropolitaine, le nombre de nouveaux cas estimés en 2012
était de 48 763 avec un âge moyen au diagnostic de 63 ans. Après avoir
augmenté de manière constante entre 2000 et 2005, des données publiées
en 2008 suggèrent une diminution de l’incidence du cancer du sein depuis
2005, possiblement en raison de la diminution de la prescription de
traitements hormonaux de la ménopause (2). Malgré tout, il reste le cancer le
plus fréquent en France après le cancer de la prostate (53 465 cas) et le
cancer le plus fréquent chez la femme. Le nombre de décès par cancer du
sein en 2012 était estimé à 11 886. La survie des patientes diagnostiquées
entre 1989 et 2004 est de 97% à 1 an, 86% à 5 ans et 76% à 10 ans (donnés
Institut National du Cancer).
Au-delà de ces données générales, il existe en fait une grande variété de
situations cliniques et biologiques rencontrées.
En France 60% des cancers du sein sont diagnostiqués au stade
localisé, 33% à un stade localement avancé et seulement 7% sont
diagnostiqués au stade métastatique (données Institut National du Cancer).
Les stades localisés sont accessibles à un traitement à visée curative. En
fonction du stade TNM initial et du souhait de la patiente le traitement
débute par une chirurgie première ou par un traitement systémique néo-
adjuvant (hormonothérapie, chimiothérapie) quand une chirurgie première
ne permettrait pas un traitement conservateur. Après la chirurgie, le
traitement adjuvant est discuté en Réunion de Concertation
Pluridisciplinaire (RCP) en tenant compte des caractéristiques tumorales,
ganglionnaires, de l’état général de la patiente et de son souhait. Plusieurs
modalités thérapeutiques peuvent être combinées : chimiothérapie,
radiothérapie, Trastuzumab en cas de surexpression d’Her2 et
hormonothérapie en cas de présence de récepteurs hormonaux au niveau de
la tumeur. La chimiothérapie adjuvante a pour but de de diminuer le risque
d’évolution métastatique de 25% environ (3)(4). Les facteurs de risque de
rechute orientant vers la réalisation d’une chimiothérapie adjuvante sont la
surexpression de l’oncogène Her2 et/ou l’absence d’expression des
récepteurs hormonaux, une taille tumorale élevée, un grade SBR élevé, un
envahissement ganglionnaire ou un Ki67/UPA ou PAI1 élevés en cas de

4
grade intermédiaire. Les tests génomiques tels que l’Oncotype DX® ou le
Mammaprint® peuvent orienter la décision mais ne sont pas recommandés
en pratique courante en France pour le moment. La chimiothérapie
adjuvante repose sur une polychimiothérapie comportant le plus souvent
une association entre une anthracycline et un taxane selon un schéma
séquentiel ou concomitant. Cependant, l’administration de ces molécules
expose à des toxicités rendant indispensable l’utilisation de voies veineuses
centrales.
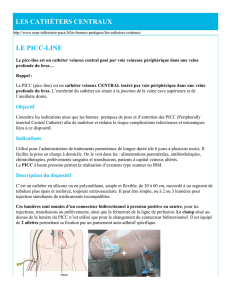
2) Intérêt des Cathéter à Chambre Implantable (CCI) et des Cathéter insérés
par voir périphérique (PICC) pour l’administration de chimiothérapie :
Les produits de chimiothérapie peuvent être vésicants (anthracyclines,
taxanes) ou irritants (fluoro-uracil). Leur emploi sur les veines périphériques
expose à un risque élevé de lésions veineuses voire d’extravasation (fuite de
produit en dehors du lit vasculaire). C’est pourquoi l’administration d’une
chimiothérapie postopératoire ne peut s’envisager qu’après la pose d’un
dispositif intraveineux (DIV) positionné dans une veine centrale (5)(6). De
plus, ces dispositifs mis en place au début du traitement permettent d’éviter
les ponctions veineuses à répétition durant les chimiothérapies et améliorent
ainsi le confort du patient (7).
Plusieurs types de cathéters peuvent être utilisés, le CCI étant
actuellement le plus répandu.
a) Avantages et inconvénients du CCI :
Les premières utilisations de CCI dans l’administration de
chimiothérapie remontent aux années 80 (8). Il s’agit d’un boîtier inséré sous
la peau en dessous de la clavicule, ou plus rarement au niveau du bras, en
général sous anesthésie locale. Ce boitier est constitué d’un cadre en
plastique et d’une membrane en silicone dans laquelle l’aiguille de perfusion
est mise en place. Cette pose a lieu au bloc opératoire et est réalisée par un
chirurgien ou un anesthésiste. Ce boîtier est connecté à un cathéter qui est
positionné dans une veine (sous-clavière ou jugulaire interne), et dont
l’extrémité se situe à la limite entre la veine cave supérieure et l’oreillette
droite. Ce cathéter est constitué de silicone ou de polyuréthane. Le CCI
présente l’avantage d’être entièrement sous la peau, ce qui est discret sur le
plan esthétique et autorise la prise de douche ou de bain. Aucun soin
particulier n’est à réaliser lorsque le CCI n’est pas utilisé. Des mesures très
strictes d’asepsie sont en revanche à respecter lors des perfusions sur le
boîtier (risque de contamination par la flore cutanée lors du passage de
l’aiguille). De plus, la mise en place de l’aiguille dans le boitier peut-être
douloureuse et nécessite une antalgie locale souvent réalisée grâce à de
l’Emla® (patch ou crème). La pose de CCI et son utilisation exposent à des
risques hémorragiques ou d’hématome (4,5%), de pneumothorax (2 à 3,4%),
d’infections locales (0,5 à 4%) et à distance (0,8 à 6%), de thrombose (1 à 5%)
et de complications mécaniques (1,5%) (9)(10)(11)(12). Son retrait est réalisé

5
de façon chirurgicale au bloc opératoire et impose au patient de revenir à
l’hôpital après la fin de ses traitements.
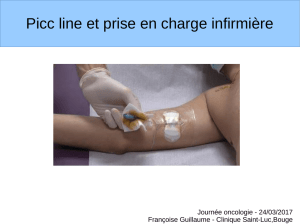
b) Avantages et inconvénients du PICC :
Initialement les PICC ont été utilisés dans le cadre d’alimentation
parentérale au long cours à partir de l’année 1975. Ils ont commencé à être
utilisés dans l’administration de chimiothérapie en 1979 (13). Le PICC est un
cathéter inséré dans une veine périphérique du bras (veine basilique ou
brachiale) sous contrôle échographique et remonté jusqu’à la jonction entre
la veine cave supérieure et l’oreillette droite. Dans les premières études ces
cathéters étaient en silicone, ils sont actuellement en polyuréthane. Ce
dispositif est largement utilisé en soins intensifs, pour l’administration
d’antibiotiques ou d’antalgiques (14)(15). Son intérêt pour la réalisation d’un
nombre limité de cures de chimiothérapie réside dans sa facilité de pose et
de retrait par rapport à un CCI. En revanche, le PICC est un dispositif
transcutané, ce qui nécessite une occlusion permanente par un pansement
et interdit toute immersion. Un nettoyage du point d’insertion, un rinçage
du cathéter et une réfection du pansement occlusif doivent être réalisés au
moins une fois par semaine, que le cathéter soit utilisé ou non
(recommandations du constructeur, Bard®). Son ablation est simple et peut
être réalisée au lit du patient par une infirmière. Le PICC expose à des
risques infectieux (2 à 7%), thromboemboliques (7 à 10%) et à des
complications mécaniques (15%) (14)(15)(16)(17)(18).
Si en France ce dispositif est pour le moment moins utilisé que le CCI pour
l’administration de chimiothérapie, il est en revanche plus répandu en
Amérique du Nord et en Asie.
3) Etats actuels des connaissances sur les CCI et les PICC dans
l’administration de chimiothérapie chez des patients atteints de cancers non
hématologiques :
Les taux de complications cités ci-dessus sont difficilement
applicables à la problématique de la chimiothérapie adjuvante. En effet, les
études publiées en oncologie concernent souvent des groupes hétérogènes de
patients comprenant tous types et tous stades de cancers solides ou
hématologiques, ainsi que différents types de traitements : chimiothérapie
(dont le caractère adjuvant ou non n’est pas précisé), autogreffe,
antibiothérapie etc.… (15)(19)(20). Il n’y a que très peu de données
comparatives entre ces deux dispositifs mais celles-ci suggèrent de plus fort
taux de complications chez les patients porteurs de PICC.
Ainsi en 2010 Kim et al. ont montré dans une étude prospective
observationnelle que les patients porteurs de PICC présentaient
significativement plus de complications mécaniques que les CCI (p<0,001).
L’utilisation des cathéters et les taux exacts de complications selon le type
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%







![Picc Line formation IDE Mars 2015 [Mode de compatibilité]](http://s1.studylibfr.com/store/data/002116840_1-89522eb39713ecd8aed09324afedd79a-300x300.png)