NIARE Sanaba 10 pages Les Maladie

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Les Maladies auto-immunes
28/09/2015
LEFEVRE Flora D1
Immunopathologie et Immunointervention
Dr Sophie DESPLAT-JEGO
CR : NIARE Sanaba
10 pages
Les Maladies Auto-Immunes
A. Notions de base
I. Soi et Non-Soi
Le soi est ce qui rend unique un individu. L’organisme d’une personne est constitué de protéines qui diffèrent
d’une personne à l’autre. Par opposition, le non-soi se définit par tout ce qui provient de l’extérieur de
l’organisme.
Le Système Immunitaire (SI) est éduqué pour distinguer le soi du non-soi (ce qui est difficile pour un
lymphocyte débutant).
La notion d’éducation lymphocytaire est très importante.
Le « soi modifié » se situe à l’interface entre le soi et le non-soi. En effet, ce qui constitue le soi n’est pas stable
et peut être modifié (biochimiquement par exemple à cause d’un médicament) et devenir du non-soi.
1/12
Plan
A. Notions de base
I. Le Soi et le Non-Soi
II. Réaction immunitaire
B. Mécanismes de l'auto-immunisation
I. Mécanismes de contrôle des LT en périphérie
II. Mécanismes de contrôle des LB en périphérie
C. Mécanismes de lésions : auto-anticorps
I. Argument en faveur du caractère pathogène des auto-Ac
II. Rôle pathogène des auto-Ac
D. Exemples de maladies auto-immunes
I. Myasthénie
II. Lupus
III. Pemphigus
IV. Syndrôme de Goujerot-Sjogren
V. Prévalence
VI. Facteurs favorisants les maladies auto-immunes

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Les Maladies auto-immunes
II. Réaction immunitaire
Elle est vitale pour l’organisme. Elle permet la lutte contre les agents pathogènes, les cellules cancéreuses, etc.
Il existe deux types de réactions immunitaires : (souvent distinguées mais très liées)
•La réaction humorale : les molécules d’intervention sont solubles (Ig ou Ac, cytokines, chémokines...
jouant le rôle d'intermédiaire entre les cellules ainsi que celui de médiateur lipidique de l'inflammation)
•La réaction cellulaire : les cellules les plus importantes sont les lymphocytes T et B. Les LT sont
produits dans la moelle osseuse et maturent dans le thymus. Les LB maturent dans la moelle osseuse.
Ces deux lymphocytes ont un précurseur commun.
CR : Les cellules préT passent dans le sang pour aller vers le thymus
1. Les lymphocytes T
Les différents devenirs d’un lymphocyte T
Un LT a plusieurs devenirs
•TH1 (différenciation plutôt cellulaire)
•TH2 (différenciation plutôt humorale)
•TH17 : ils ont été découverts récemment et sont très impliqués dans les maladies auto-immunes. Ils
produisent notamment de l'IL17 et de l'IL12.
•Treg : il en existe deux sous-types : les Tr1 qui sont des régulateurs naturels, constamment produits par
le thymus et les Tri qui sont eux inductibles et produits sous l’influence du TGFβ.
Les Treg ont pour rôle de moduler les réactions immunitaires. Ainsi, on remarque souvent un défaut de
fonction ou de production des Treg dans les Maladies auto-immunes (MAI)
•T folliculaire
Le savoir concernant les lymphocytes est en évolution constante.
Activation et Prolifération d’un LT
La Cellule présentatrice d’antigène (CPA) engendre trois signaux lorsqu’elle se fixe au LT.
•Le complexe HLA/Ag est reconnu par le complexe
TLR/CD3/CD4 (induisant le premier signal)
•Les molécules B7-1 et B-2 sont reconnues par le CD28 du
LT (induisant le deuxième signal aussi appelé le co-signal)
•IL2 se fixe sur son récepteur induisant le troisième signal
qui s’auto-entretient
2/12

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Les Maladies auto-immunes
Les trois signaux réunis permettent la prolifération du LT. Cette prolifération est clonale ce qui signifie qu'il va
y avoir une production de très nombreux lymphocytes reconnaissant le même épitope.
Cependant, le LT peut aussi rentrer en anergie dans le cas où B7-1 et B7-2 se fixent sur CTLA-4 et non sur
CD28.
2. Antigènes et Anticorps
Un antigène (Ag) est constitué de plusieurs épitopes. Un anticorps (Ac) peut reconnaître juste un des épitopes
d’un Ag. Donc un Ag peut être reconnu par plusieurs Ac différents chacun spécifiques d’un épitope. C’est la
raison pour laquelle la réponse immune est dite polyclonale (plusieurs Ac pour un même Ag).
3. Le Thymus
Le thymus est une glande situé dans le thorax juste derrière sternum. Son rôle est la sélection et l’éducation des
LT.
Il involue avec l’âge mais il ne perd pas ses fonctions (il y a en effet une augmentation du volume graisseux
mais une persistance de la fonction, en cas de besoins il peut rééduquer une grande quantité de lymphocytes).
Il est constitué de lobules chacun formé d’une médullaire et d’un cortex.
•Dans la médullaire on trouve des LT, des cellules thymiques épithéliales, des Ag du soi et le corpuscule
de Hassal.
La présence d’Ag du soi est très importante pour la sélection des LT auto-réactifs. Cependant ils ne représentent
pas tous les Ag du soi présents dans l’organisme.
La sélection d’un LT se fait en testant la reconnaissance de l’Ag et la distinction entre le soi et le non-soi. Cette
éducation est très sélective (seul 2% des précurseurs LT deviennent des LT effectifs).
Etapes de maturation des LT : Les pré-LT vont de la moelle osseuse au thymus. Dans le cortex a lieu une
sélection positive. Les LT sélectionnés positivement passent dans la médullaire où a lieu une sélection négative.
•La sélection positive vérifie que le LT sait reconnaître un Ag (dans le cas contraire il est éliminé). Il
faut donc pour passer cette sélection positive que le LT possède le TCR nécessaire à la reconnaissance
d'une cellule possédant le complexe Ag-HLA.
•La sélection négative vérifie que le LT ne reconnaît pas les Ag du soi (dans le cas contraire il est
éliminé). Cette sélection est dite ag dépendante et fait intervenir des cellules dendritiques.
Les LT sélectionnés reconnaissent les Ag du
non-soi et deviennent des cohortes LT
CD4+, CD8 et LTreg naturels (Tri).
3/12

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Les Maladies auto-immunes
Cependant le système est imparfait et il existe des LT auto-réactifs en circulation. Chez un individu sain, ces
clones auto-réactifs sont régulés et maintenus en sommeil, ils ne prolifèrent pas.
On parle de MAI quand l’auto-immunité (humorale et cellulaire) devient trop importante et chronique et
entraîne des lésions tissulaires. Ces lésions tissulaires sont des lésions histologiques qui peuvent toucher un ou
plusieurs organes. Elles ne sont pas pathognomoniques d’une maladie. De fait, l’atteinte clinique est difficile à
diagnostiquer précisément.
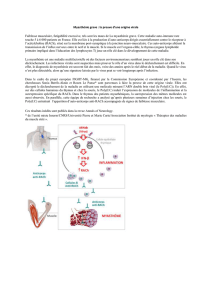
Il existe des dizaines de MAI : des maladies spécifiques d’organe (comme le diabète insulino-dépendant, les
MAI de la peau ou la myasthénie) et des maladies systémiques avec une atteinte de plusieurs organes
(simultanément ou séquentiellement) comme le lupus érythémateux systémique ou la polyarthrite rhumatoïde.
Certaines MAI sont assez courantes (Polyarthrite rhumatoïde, maladies du thymus, diabète insulino-dépendant,
syndrome de Gougerot-Sjödren, maladie cœliaque).
B. Mécanismes de l’auto-immunisation
L’échappement à la tolérance des lymphocytes fait que les LB et LT auto-réactifs activés et mal contrôlés
entraînent des lésions tissulaires et donc une MAI.
Qu’est ce qui provoque cet échappement à la tolérance ?
Il existe une tolérance centrale impliquant le thymus et la moelle osseuse mais aussi une tolérance périphérique.
La tolérance périphérique est un mécanisme additionnel de contrôle qui permet la présence physiologique de
LB et de LT auto-réactifs circulants.
4/12

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Les Maladies auto-immunes
I. Mécanismes de contrôle des LT en périphérie
•IGNORANCE : Certains Ag du soi ne sont pas exprimés par le thymus, il n’y a donc pas de sélection
efficace des LT. Certains Ag sont séquestrés dans un tissu peu exposé au système immunitaire, c’est le
cas des Ag de l’œil. En cas de libération de ces Ag ils seront reconnus comme des Ag du non-soi (uvéite
auto immune). Il existe des Ag cryptiques qui sont cachés dans une molécule auto-immune, s’ils
deviennent accessibles, ils entraînent une MAI. Sous l'action d'un agent chimique, d'un médicament
(etc...) ces Ag vont changer de conformation tridimensionnelle et les épitopes cachés seront accessibles
au SI qui va les reconnaître en tant qu'Ag du non soi.
•ANERGIE : absence de signaux de co-stimulation
•D ELETION CLONALE PERIPHERIQUE : induite par une forte dose d’auto-Ag qui entraîne une
délétion clonale pour protéger l’organisme.
•LYMPHOCYTE T REG
Ces mécanismes, en cas de MAI, sont pris en défaut.
Un nombre trop important d’auto-Ag libéré ou un mimétisme moléculaire (virus ou bactérie dont la structure
trop proche des Ag du soi trompent les LT et activent une immunité « inutile »)
NB : les auto-Ag sont des Ag du soi qui sont anormalement reconnus comme étrangers et entraînent des
réactions du système immunitaire.
II. Mécanismes de contrôle des LB en périphérie
•ANERGIE ou DELETION des LT : elle entraîne une anergie des LB car il y a une coopération cellulaire
pour la production d’Ac (notamment pour les Ag thymo-dépendants)
•ANERGIE par contact avec les auto-Ag circulants solubles
•DELETION CLONALE PERIPHERIQUE : induite par forte dose d’auto-Ag (supérieure à celle des LT)
Un défaut dans l’un de ces mécanismes de contrôle entraîne une auto-immunisation.
Les lésions tissulaires sont donc dues à l’auto-immunité pathologique (action délétère d’auto-Ac et/ou de
lymphocytes auto-réactifs).
5/12
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%