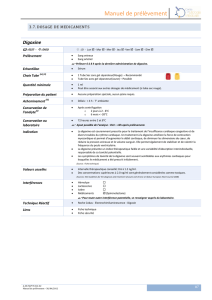
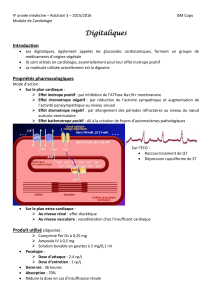
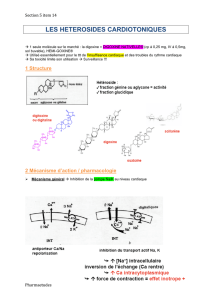
Le suivi thérapeutique pharmacologique de la digoxine

لاجـــمــيروهةــ يرئازحلاــقميدلا ةـــيطارــشلا ةــعــةيب
République Algerienne Dmocrtaique et Populaire
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE ABOU BEKR BELKAID
FACULTE DE MEDECINE
DR.B. BENZERJEB –TLEMCEN
DEPARTEMENT DE PHARMACIE
THÈME :
Le suivi thérapeutique pharmacologique de la
digoxine : intérêt des concentrations sériques
thérapeutiques basses
Présenté par :
Sifoune Keltoum
Encadreur : Dr. Benaouda Amina Maitre assistante en toxicologie
Année universitaire : 2014/2015
MEMOIRE DE FIN D’ETUDES POUR
L’OBTENSTION DU DIPLOME EN PHARMACIE

Remerciements
La réalisation de ce mémoire a été possible grâce à mon DIEU et grâce au concours
de plusieurs personnes à qui je voudrais témoigner toute ma reconnaissance.
Je voudrais tout d'abord adresser toute ma gratitude au docteur BENAOUDA
AMINA, ma directrice de mémoire, pour tout le soutien, l'aide, l'orientation, la
guidance qu'elle m'a apportés durant toute l’année ainsi que pour ses précieux conseils
et ses encouragements lors de la réalisation de mon mémoire.
Je remercie mes très chers parents, RAMDANE et GHALIA, qui ont toujours été là
pour moi, « Vous avez tout sacrifié pour vos enfants n’épargnant ni santé ni efforts.
Vous m’avez donné un magnifique modèle de labeur et de persévérance. Je suis
redevable d’une éducation dont je suis fier ».
Je remercie mes frères ABD ELGHAFOUR et AISSA pour leur encouragement. Je
remercie très spécialement mon fiancé HAMDI SOUFIANE qui a toujours été là pour
moi. Je tiens à remercier ma sœur SEDDAR ZOULEYKHA, pour son amitié, son
soutien inconditionnel et son encouragement.
Je voudrais exprimer ma reconnaissance envers les amies (Imane, Hanane, Houda,
Karima, Hanane, Fatima, Amel, Lamia,...) et collègues qui m’ont apporté leur support
moral et intellectuel tout au long de ma démarche.
Enfin, je voudrais remercier toutes les personnes qui ont participé de près ou de loin à
mes recherches et à l’élaboration de ce mémoire.
À tous ces intervenants, je présente mes remerciements, mon respect et ma gratitude.

Liste des abréviations
1
IC : insuffisance cardiaque
BAV : Bloc auriculo-ventriculaire
FA : Fibrillation auriculaire
IVG : Insuffisance ventriculaire gauche
IVD : Insuffisance ventriculaire droite
AVC : accident vasculaire cérébrale
ECG : électrocardiogramme
VES : volume du sang éjecté
FC : fréquence cardiaque
DC : débit cardiaque
HTA : hyper tension artérielle
IEC : inhibiteurs de l’enzyme de conversion
AMM : autorisation de mise sur le marché
SNA : système nerveux autonome
AV : auriculo-ventriculaire
IV : intraveineux
Vd : volume de distribution
SNC : système nerveux central
DIG : digitalis invetigation group
TSV : Tachycardies supra-ventriculaires
STP : Le suivi thérapeutique pharmacologique
TDM : Therapeutic Drug Monitoring
AC : anticorps
AG : antigène
PAL : phosphatase alcaline
ELISA : Enzyme Linked Immuno Sorbent Assay
RIA : Radio-immunoassay
LCR : liquide céphalo-rachidien
EMIT : technique immuno-enzymatique-multiplié

Liste des abréviations
2
FPIA : Technique immunologique par polarisation en fluorescence
CEDIA : cloned enzyme immuno donnor assay
DLIS : digoxine-like substances immunoréactives
LC : Chromatographie liquide
MS : spectrométrie de masse

Liste des figures
3
Figure 1 : Structure du cœur………………………………………………………….14
Figure 2 : Conduction électrique du cœur…………………………………………....15
Figure 3 : Schéma d’une cellule cardiaque au repos (polarisée)……………………..16
Figure 4 : Schéma d’une cellule cardiaque durant la repolarisation…………………17
Figure 5 : Schéma d’une cellule cardiaque dépolarisée……………………………...17
Figure 6 : Les phases du potentiel d’action d’une cellule du muscle cardiaque……..18
Figure 7 : Les phases du potentiel d’action d’une cellule du nœud SA……………..18
Figure 8 : Potentiel d’action myocardique (A) et conductances ioniques de la
membrane du cardiomyocyte (B)…………………………………………………….19
Figure 9 : Couplage excitation contraction dans la cellule du muscle cardiaque…....21
Figure 10 : Electrocardiogramme normale…………………………………………..22
Figure 11 : Publication de Leonhart Fuchs…………………………………………..34
Figure 12 : William Withering et son ouvrage……………………………………….35
Figure 13 : Digitalis purpurea Figure………………………………………………...36
Figure 14: Digialis lanata……………………………………………………………36
Figure 15 : Cyclopentanoperhydrophenanthrène…………………………………….36
Figure 16 : Structure des digitaliques………………………………………………...37
Figure 17 : Configuration cis et trans des noyaux A et B…………………………....37
Figure 18 : Mécanisme d’action des digitaliques…………………………………………….38
Figure 19 : Effets de la digitale sur la phase de repolarisation……………………....42
Figure 20 : Vue d'ensemble des effets de la digoxine………………………………..45
Figure 21 : Métabolites de la digoxine et dela digitoxine……………………………47
Figure 22 : Similarités de structure entre les digitaliques et les stéroïdes……………………67
Figure 23 : Représentation schématique d’une immunoglobuline…………………………...75
Figure 24 : La digestion papaînique…………………………………………………….........75
Figure 25 : Mode d’action des Fab…………………………………………………………...76
Figure 26 : Graphe représentant le temps de prélèvement avant et après la phase de
distribution…………………………………………………………………………………….93
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
1
/
134
100%