Qui a besoin d`un cardioverter-défibrillateur

Qui a besoin d’un cardioverter-défibrillateur-
implantable (ICD)?
Robert Blank, Beat Schaer, Dagmar I. Keller, Christian Sticherling, Stefan Osswald
Abteilung für Kardiologie, Universitätsspital Basel
curriculum Forum Med Suisse 2008;8(18–19):332–335 332
environ 1000 personnes. Sans aucun doute, cela
mènerait notre système de santé à la ruine. En
outre, il y aurait souvent des décharges inadéqua-
tes et des complications inutiles.
Il faut donc définir pour quels patients et à quel
stade de la maladie un ICD est indiqué, de même
que le cadre raisonnable du rapport coût-béné-
fice. Les différentes sociétés de discipline éditent
régulièrement des recommandations s’appuyant
sur les études disponibles [3]. Il faut tout d’abord
définir si l’ICD doit être implanté en prévention
primaireousecondaireaprèsaccidentarythmique
non fatal.
Fonctionnement d’un ICD
La principale fonction d’un ICD est de délivrer
un électrochoc pour terminer une arythmie ventri-
culaire maligne. Les ICD ont également l’option
d’arrêter sans douleur une tachyarythmie par
une hyperstimulation, dite pacing antitachycardie
(ATP). Cela produit parfois une accélération de la
tachycardie ventriculaire en fibrillation ventricu-
laire, qui doit être corrigée par un choc. Le choc
est douloureux pour le patient, s’il est encore
conscient. Par contre, l’entourage ne court aucun
risque, même au contact direct de la peau du pa-
tient. Cinq à quinze secondes s’écoulent avant le
choc, car l’ICD doit analyser le rythme et charger
ses condensateurs. Ce temps de charge s’allonge
en fonction de l’âge de l’appareil.
Tout défibrillateur comporte en outre des fonctions
de pacemaker moderne. Il peut s’agir d’un sys-
tème monoventriculaire (mode VVI) ou biventricu-
laire (VDD ou DDD). L’association à un pacemaker
biventriculaire est possible pour une resynchroni-
sation cardiaque simultanée (CRT) (fig. 1 x).
L’implantation d’un ICD se fait généralement en
anesthésie locale et sous analgésie, parfois même
en ambulatoire.
ICD en prévention secondaire
de la mort cardiaque subite
L’étude AVID (Antiarrythmics vs Implantable De-
fibrillator) a pu montrer en 1997 que les patients
ayant survécu à une fibrillation ou une tachycar-
Introduction
En Europe, la mort cardiaque subite est l’une des
causes de décès les plus fréquentes. Pratiquement
400 000 personnes en meurent chaque année [1].
Elle résulte dans la plupart des cas d’une tachy-
arythmie ventriculaire [2]. Les autres étiologies,
comme l’infarctus du myocarde ou la dissociation
électromécanique, sont nettement plus rares.
Théoriquement, chacun d’entre nous court le
risque de présenter une tachyarythmie et d’être
victime d’une mort cardiaque subite. On pour-
rait penser que, par mesure de sécurité, chacun
de nous devrait se faire implanter un ICD (Implan-
table Cardioverter Defibrillator). Avec quelque
40000 francs par appareil et vu la très faible inci-
dence de la mort cardiaque subite dans la popula-
tion en général, de 0,1–0,2% [3], cela donnerait
un Number Needed to Treat (NNT) très élevé, soit
Vous trouverez les questions à choix multiple concernant cet article à la page 329 ou sur internet sous www.smf-cme.ch.
Quintessence
En Europe, pratiquement 400000 personnes sont chaque année victimes d’une
mort cardiaque subite, résultant pour la plupart d’une cardiopathie ischémique.
Il est admis que la mort cardiaque subite est généralement le fait de tachyaryth-
mies ventriculaires. Un défibrillateur implantable (ICD) est donc l’option théra-
peutique adéquate pour la prévenir. Plusieurs grandes études ont pu démontrer
l’efficience de l’ICD chez des patients souffrant de cardiopathie ischémique ou
non ischémique. Le traitement par un ICD est cependant fondamentalement dif-
férent du traitement médicamenteux, surtout pour ses coûts initiaux qui impo-
sent une bonne stratification du risquepour sélectionner les bons candidats à
l’implantation d’un ICD.
Summary
Who needs an implantable cardioverter defibrillator
(ICD)?
Sudden cardiac death (SCD) accounts for almost 400000 deaths annually in Eu-
rope and occurs chiefly in patients with underlying coronary artery disease.
Since ventricular arrhythmias are believed to be the major cause of such deaths
the implantable cardioverter defibrillator (ICD) is the appropriate therapeutic
option for SCD prevention. Several large-scale randomised trials have docu-
mented the efficacy of ICD implantation for primary or secondary prevention
of SCD in patients with ischaemic or non-ischaemic cardiomyopathy. However,
ICD therapy differs substantially from drug therapy, particularly with regard to
initial cost. Optimal use of this therapy requires appropriate risk stratification
methods to identify the patients who will derive greatest benefit.
332-335 Blank 147_f.qxp 17.4.2008 12:57 Uhr Seite 332

curriculum Forum Med Suisse 2008;8(18–19):332–335 333
triculaire gauche (LVEF <30%), mais qui contrai-
rement à l’étude MADIT ne devaient pas néces-
sairement présenter d’autres paramètres tels que
tachycardies ventriculaires transitoires et induc-
tibles nonsuppressibles. Cette étude a renoncé
à l’examen électrophysiologique avec induction
de tachycardies ventriculaires. La mortalité car-
diaque a pu être abaissée de 31% (risque relatif)
dans cette étude également, et ceci indépendam-
ment de l’âge, du sexe, de la fraction d’éjection,
des facteurs de risque et de la largeur du QRS [6].
Le NNT a été de 11 patients en trois ans.
Les preuves sont ainsi actuellement données pour
l’implantation d’un ICD chez des patients ayant
survécu à leur infarctus du myocarde avec une
grave dysfonction ventriculaire gauche chronique
(LVEF <30%). Les guidelines AHA/ACC/ESC en
font une indication de classe IA, ce qui veut dire
que le bénéfice et l’efficacité sont prouvés et qu’il
existe de grandes études randomisées [3]. Mais il
ne faut pas implanter un ICD immédiatement après
l’infarctus. Dans l’étude DINAMIT (Defibrillator
in Acute Myocardial Infarction Trial), l’implanta-
tion d’un ICD 6 à 40 jours après l’infarctus n’a pas
abaissé la mortalité [7]. Comme la fonction ven-
triculaire gauche peut s’améliorer après revascu-
larisation dans les semaines suivant l’infarctus,
après récupération d’une sidération du ventricule
gauche, il faut commencer par suivre l’évolution
échocardiographique avant de poser l’indication
définitive.
S’il y a une cardiopathie ischémique et si la fonc-
tion ventriculaire n’est que modérément diminuée
(LVEF 40%), il s’agit également d’une indication
IA, si l’ECG à long terme montre des tachycardies
ventriculaires transitoires et asymptomatiques,
et si des tachycardies prolongées peuvent être dé-
clenchées lors de l’examen électrophysiologique.
Cette recommandation repose sur l’étude MUSTT
(Multicenter Unsustained Tachycardia Trial), qui
aexaminéaprèsrandomisation 704 patients ayant
des tachycardies ventriculaires prolongées, induc-
tibles. Comparativement au traitement antiaryth-
mique, il y a eu une diminution très nette de la mor-
talité après implantation d’un ICD [8]. Le risque
relatif a été abaissé de 27% et le NNT a été de
5 patients en trois ans.
ICD en prévention primaire
dans la cardiomyopathie
non ischémique
Les données pour l’indication à l’implantation
d’un ICD ne sont pas si évidentes chez les patients
souffrant d’une cardiomyopathie dilatative. Les
expériences s’appuient ici surtout sur deux études:
DEFINITE (Defibrillator in Non-Ischemic Cardio-
myopathy Trial) et SCD-HeFT (Sudden Cardiac
Death-Heart Failure Trial). Les guidelines actuel-
les ne donnent encore aucune recommandation
claire.
dieventriculaire,avecgravessymptômescliniques
avant leur incorporation dans l’étude, profitent
nettement de l’implantation d’un ICD. Le risque
relatif de mort cardiaque subite a pu être abaissé
de 39% la première année, comparativement au
groupe traité par médicaments. Cette étude a été
interrompue avant terme par la Food and Drug
Administration (FDA) en raison de ses résultats
hautement significatifs. Dans cette étude, le NNT
a été de 9 patients en trois ans [4].
Si l’arythmie n’a aucune étiologie corrigible (par
ex. déséquilibre électrolytique dans les 48 heures
après infarctus du myocarde), il est relativement
facile de poser l’indication à l’implantation d’un
défibrillateur. S’il y a une pathologie maligne non
cardiaque, ou si le patient est très âgé, l’indica-
tion doit être très soigneusement posée.
ICD en prévention primaire
dans la cardiopathie ischémique
L’étude MADIT (Multicenter Automatic Defibril-
lator Trial) est la première grande étude prospec-
tive randomisée consacrée à ce sujet. Elle a incor-
poré des patients postinfarctus (plus de 3 semaines
après l’infarctus) ayant une fonction ventriculaire
gauche systolique nettement abaissée (fraction
d’éjection (LVEF) inférieure ou égale à 35%) et des
épisodes prolongés (plus de 30 s) de tachycardie
ventriculaire asymptomatique, transitoires et in-
ductibles, ne réagissant pas à la procaïnamide. Ces
patients ont été randomisés pour recevoir un trai-
tement antiarythmique médicamenteux ou se faire
implanter un ICD. Avec une mortalité globale infé-
rieure de 54% après 27 mois dans le groupe ICD,
cette étude a elle aussi été interrompue prématu-
rément. La diminution du risque absolu a été de
23%, le NNT de 4 patients en 2,4 ans [5]. L’étude
MADIT II a confirmé ce résultat par la suite chez
des patients un mois au moins après un infarctus
du myocarde et ayant une grave dysfonction ven-
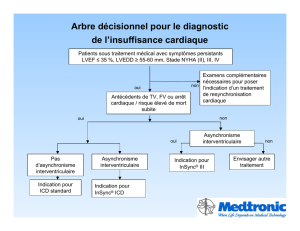
Figure 1
ICD biventriculaire, implantation de gauche (les astérisques désignent les deux électrodes de choc).
*
*
*
*
332-335 Blank 147_f.qxp 17.4.2008 12:57 Uhr Seite 333

curriculum Forum Med Suisse 2008;8(18–19):332–335 334
la décision dynamique de l’implantation d’un ICD
sont cliniquement importantes.
ICD dans la cardiomyopathie ventriculaire
droite arythmogène (CVDA)
La cardiomyopathie ventriculaire droite arythmo-
gène (CVDA) est une cardiomyopathie touchant
d’abord le ventricule droit, cause fréquente de ta-
chyarythmies dangereuses et de mort cardiaque
subite. De plus en plus de cas de mort subite sont
rapportéschezdes patients et sportifs jeunes ayant
un cœur apparemment normal, mais présentant
une CVDA. Les personnes souffrant de CVDA ne
doivent donc en principe pratiquer aucun sport.
Le traitement antiarythmique par amiodarone et
bêtabloquant est le plus important.
Les patients ayant des tachycardies ventriculaires
prolongéesouunefibrillationventriculaire doivent
se faire implanter un ICD [3]. Mais l’implantation
d’un ICD en prévention primaire de la mort car-
diaque subite n’a pas encore été examinée suffi-
samment.
ICD dans le syndrome de Brugada
LesyndromedeBrugadaestunepathologiearyth-
mogène avec anomalies ECG typiques et risque
accru de mort cardiaque subite.
L’ECG montre un bloc de branche droite atypique
et des surélévations ST typiquement pointues
dans les dérivations précordiales droites [14]. Les
patients ayant ces anomalies ECG typiques de
Brugada et des symptômes tels que syncopes, évo-
catrices d’une arythmie, courent le plus grand
risque de mort cardiaque subite [15]. L’indication
est de clase I C. Chez les patients jusqu’ici asymp-
tomatiques et sans marqueur de risque accru, l’in-
dication n’est que IIb-C, c.-à-d. que l’implantation
d’un ICD peut être envisagée, mais il n’y a aucune
étude importante à ce sujet.
ICD dans le syndrome du QT long
Le syndrome du QT long (SQTL) familial est une
maladie arythmogène congénitale. Comme dans
le syndrome de Brugada, il y a une anomalie géné-
tique des canaux ioniques, et cette maladie touche
surtout des personnes jeunes, par ailleurs sans
problèmecardiaque[16].LeSQTL est relativement
fréquent, avec une prévalence de un pour 5000,
et se caractérise par un allongement non constant
du temps QTcà l’ECG de surface [17]. Chez les pa-
tients symptomatiques, des tachyarythmies ma-
lignes, en général des torsades de pointe, peuvent
se déclencher, avec syncopes et mort cardiaque su-
bite possibles. L’indication au traitement est tou-
jours donnée chez les patients symptomatiques,
au début par bêtabloquants. Ils sont efficaces sur-
tout dans la sous-forme LQT-1, beaucoup moins
dans les sous-formes LQT-2 et LQT-3 [18]. Dans la
forme LQT-3, une bradycardie sous bêtabloquants
peut même déclencher une arythmie maligne. Ces
patients doivent donc être mis à l’abri de toute
bradycardie et il faut envisager l’implantation d’un
L’étude DEFINITE a randomisé 458 patients ayant
une cardiopathie non ischémique, une dysfonction
ventriculaire gauche (LVEF <36%) et des tachy-
cardies ventriculaires transitoires ou plus de dix
extrasystoles ventriculaires par heure sur l’ECG
enregistré en continu, ces patients ayant bénéficié
soit d’un ICD, soit d’un traitement médicamenteux
conventionnel. L’implantation d’un ICD a abaissé
sensiblement mais non significativement la mor-
talité globale (7,9% contre 14,1%; p = 0,008).
Mais cette étude est probablement statistique-
ment insatisfaisante en raison de son trop petit
collectif et de la mortalité globalement très faible
[9].
L’étude SCD-HeFT a donné une tendance en faveur
d’une meilleure survie pour les patients ayant
une fonction systolique diminuée (LVEF 35%). Le
NNT a été de 12 patients en cinq ans [10].
ICD dans des pathologies rares
ICD dans la cardiomyopathie hypertrophique
(obstructive) (CMH)
La cardiomyopathie hypertrophique (obstructive)
(CMH) est une pathologie congénitale du myo-
carde dont la prévalence est de 0,2% dans la po-
pulation globale [11]. Cette maladie est la cause
la plus fréquente de mort subite chez les jeunes,
et la mortalité des patients atteints de CMH peut
atteindre 6% par an [12]. Il est généralement ad-
mis que la mort cardiaque subite dans la CMH ré-
sulte d’arythmies ventriculaires. L’estimation du
risque de mort cardiaque subite se fait selon
l’ACC/ESC consensus report on hypertrophic car-
diomyopathy [13]. Les principaux facteurs de
risque de mort cardiaque subite sont:
–anamnèse familiale positive de mort subite,
–anamnèse de syncope ou présyncope d’étiolo-
gie indéterminée,
–hypertrophie ventriculaire gauche massive
(épaisseur du septum >30 mm),
–survie à une mort subite,
–tachyarythmies ventriculaires transitoires ou
prolongées,
–chute de tension ou absence d’ascension de
tension à l’effort (ergométrie).
La recommandation officielle actuelle pour l’im-
plantation d’un ICD n’est que de IIa chez les pa-
tients avec une CMH. Mais elle est donnée dès
qu’il y a un facteur de haut risque. Dans une étude
multicentrique, l’ICD a mis fin avec succès à des
arythmies ventriculaires potentiellement fatales
chez 25% des patients sur une durée de trois ans.
Les patients ayant reçu une décharge étaient ten-
danciellement plus jeunes (moyenne d’âge 40 ans)
et leurs arythmies ne se sont souvent produites
qu’après une latence très longue [12]. Le rapport
coût-efficacité de ces appareils est certainement
le meilleur chez des patients jeunes. L’évaluation
des facteurs de risque tous les deux ans, et donc
332-335 Blank 147_f.qxp 17.4.2008 12:57 Uhr Seite 334

curriculum Forum Med Suisse 2008;8(18–19):332–335 335
pacemaker. Si malgré les bêtabloquants les syn-
copes continuent, avec fibrillation ventriculaire
ou réanimation, l’implantation d’un ICD est indi-
quée [3] tout en poursuivant les bêtabloquants.
La pyramide de Priori et al. sert à stratifier le
risque de mort cardiaque subite des sous-formes
du syndrome LQT-1 à 3.
Que doit savoir le patient?
Les patients doivent connaître le fonctionnement
de leur appareil et s’attendre à une décharge élec-
trique. Ils doivent également savoir qu’en préven-
tion secondaire, ils n’ont pas le droit de conduire
pendant six mois après l’implantation et doivent
savoir comment réagir lorsque l’appareil délivre
un choc. L’implantation d’un ICD est une interven-
tion majeure pour de nombreux patients, et cer-
tains ont même besoin pendant quelque temps
d’un soutien psychologique. Il est également pos-
sible qu’ils reçoivent des chocs inappropriés.
Avec une incidence pouvant atteindre 27%, ils
sont même relativement fréquents [19]. Ils sont
possibles par ex. avec une fibrillation auriculaire,
car l’appareil peut les reconnaître par erreur
comme une arythmie ventriculaire, bien qu’il dis-
pose d’algorithmes lui permettant de différencier
ces arythmies. Il peut en outre y avoir des in-
fluences électromagnétiques ou des ruptures
d’électrodes, provoquant des dysfonctionnements
des appareils. Avant toute opération, les ICD doi-
vent être déclenchés pour prévenir tout choc ina-
déquat résultant de signaux perturbateurs (noise)
par l’électrocautère. Lorsque l’appareil est dé-
clenché, le patient doit être monitorisé en per-
manence.Plusieurs patients souhaitent également
que leur appareil soit déclenché au stade termi-
nal d’une maladie maligne. Ce sont tous des points
importants devant être préalablement discutés
avec le patient et ses proches. Comme ces appa-
reils très complexes doivent être contrôlés régu-
lièrement, il est important que le suivi soit assuré
par un centre ICD spécialisé [20].
Références
1DeVreede-Swagemakers JJ, Gorgels AP, Dubois-Arbouw
WI, et al. Out of-hospital cardiac arrest in the 1990’s: a pop-
ulation-based study in the Maastricht area on incidence,
characteristics and survival. J Am Coll Cardiol. 1997;30:
1500–5.
2Weaver DW. Considerations for improving survival from
out-of-hospital cardiac arrest. Ann Emerg Med. 1986;15:
1181–6.
3Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006
guidelines for management of patients with ventricular ar-
rhythmias and the prevention of sudden cardiac death: a re-
port of the American College of Cardiology/American Heart
Association Task Force and the European Society of Cardi-
ology Committee for Practice Guidelines (Writing Commit-
tee to Develop guidelines for management of patients with
ventricular arrhythmias and the prevention of sudden car-
diac death) developed in collaboration with the European
Heart Rhythm Association and the Heart Rhythm Society.
Europace. 2006:8:746–837.
4TheAntiarrhythmics versusImplantable Defibrillators (AVID)
Investigators. A comparison of antiarrhythmic-drug therapy
with implantable defibrillators in patients resuscitated from
near-fatal ventricular arrhythmias. N Engl J Med. 1997;337:
1576–83.
5Moss AJ, Hall WJ, Cannom DS, et al. Improved survival with
an implanted defibrillator in patients with coronary disease
at high risk for ventricular arrhythmia. Multicenter Auto-
matic Defibrillator Implantation Trial Investigators. N Engl
J Med. 1996;335:1933–40.
6Moss AJ, Zareba W, Hall WJ, et al. Multicenter Automatic
Defibrillator Implantation Trial II Investigators (2002) Pro-
phylactic implantation of a defibrillator in patients with my-
ocardial infarction and reduced ejection fraction. N Engl J
Med. 2002;346:877–83.
7Hohnloser SH, Kuck KH, Dorian P, et al. Prophylactic use of
an implantable cardioverter-defibrillator after acute my-
ocardialinfarction. N Engl J Med. 2004;351:2481–8.
8Buxton AE, Lee KL, Fisher JD, et al. A randomized study of
the prevention of sudden death in patients with coronary ar-
tery disease. N Engl J Med. 1999;341:1882–90.
9Kadish A, Dyer A, Daubert JP, et al. Defibrillators in Non-Is-
chemic Cardiomyopathy Treatment Evaluation (DEFINITE)
Investigators (2004) Prophylactic defibrillator implantation in
patients with nonischemic dilated cardiomyopathy. N Engl
J Med. 2004;350:2151–8.
10 Bardy GH, Lee KL, Mark DB, et al. Sudden Cardiac Death in
Heart Failure Trial (SCD-HeFT) Investigators (2005) Amio-
darone or an implantable cardioverter-defibrillator for con-
gestive heart failure. N Engl J Med 2005;352:225–37.
11 Maron BJ, Gardin JM, Flack JM, et al. Prevalence of hyper-
trophic cardiomyopathy in a general population of young
adults: echocardiographic analysis of 4111 subjects in the
CARDIA study. Circulation. 1995;92:785–9.
12 Maron BJ, Shen W-K, Link MS, et al. Efficacy of implantable
cardioverter-defibrillators for the prevention of sudden death
in patients with hypertrophic cardiomyopathy. N Engl J Med.
2000;342:365–73.
13 Maron BJ, McKenna W, Danielson GK, et al. ACC/ESC clini-
cal expert consensus document on hypertrophic cardiomy-
opathy: a report of the American College of Cardiology Task
Force on Clinical Expert Consensus Documents and the Eu-
ropean Society of Cardiology Committee for Practice Guide-
lines (Committee to Develop an Expert Consensus Document
on Hypertrophic Cardiomyopathy). J Am Coll Cardiol. 2003;
42:1687–713.
14 Brugada P, Brugada J. Right bundle branch block, persist-
ent ST segment elevation and sudden cardiac death: a dis-
tinct clinical and electrocardiographic syndrome: a multi-
center report. J Am Coll Cardiol. 1992;20:1391–6.
15 Priori SG, Napolitano C, Gasparini M, et al. Natural history
of Brugada syndrome: insights for risk stratification and
management. Circulation. 2002;105:1342–7.
16 Chiang CE, Roden DM. The long QT syndrome: Genetic bases
and clinical implications. J Am Coll Cardiol. 2000;36:1–12.
17 Haverkamp W, Rolf S, Eckardt L, et al. Long QT syndrome
and Brugada syndrome. Drugs, ablation or ICD? Herz. 2005;
30:111–8. Review.
18 Priori SG, Napolitano C, Schwartz PJ, et al. Association of
long QT syndrome loci and cardiac events among patients
treated with betablockers. JAMA. 2004;292:1341–4.
19 Nunain SO, Roelke M, Trouton T, et al. Limitations and late
complications of third-generation automatic cardioverter-
defibrillators. Circulation. 1995;91:2204–13.
20 Schaer BA, Sticherling C, Osswald S. What are the profes-
sional and logistic demands to appropriately follow patients
with an implantable cardioverter-defibrillator? J Intern
Med. 2006;260:88–92.
Correspondance:
Prof. Stefan Osswald
Leitender Arzt
Abteilung für Kardiologie
Universitätsspital Basel
Petersgraben 4
CH-4031 Basel
332-335 Blank 147_f.qxp 17.4.2008 12:57 Uhr Seite 335

Wer braucht einen implantierbaren Cardioverter-Defibrillator (ICD)?
Robert Blank, Beat Schär, Dagmar Keller, Christan Sticherling, Stefan Osswald
Abteilung für Kardiologie, Universitätsspital Basel
Literatur
1 de Vreede-Swagemakers JJ, Gorgels AP, Dubois-Arbouw WI, et al. Out of-hospital cardiac arrest in the 1990’s: a population-
based study in the Maastricht area on incidence, characteristics and survival. J Am Coll Cardiol. 1997;30:1500–5.
2 Weaver DW. Considerations for improving survival from out-of-hospital cardiac arrest. Ann Emerg Med. 1986;15:1181–6.
3 Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular
arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart
Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to
Develop guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death)
developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Europace. 2006:8:746–
837.
4 The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic-drug therapy with
implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med. 1997;337:1576–83.
5 Moss AJ, Hall WJ, Cannom DS, et al. Improved survival with an implanted defibrillator in patients with coronary disease at high
risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med.
1996;335:1933–40.
6 Moss AJ, Zareba W, Hall WJ, et al. Multicenter Automatic Defibrillator Implantation Trial II Investigators (2002) Prophylactic
implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med. 2002;346:877–
83.
7 Hohnloser SH, Kuck KH, Dorian P, et al. Prophylactic use of an implantable cardioverter-defibrillator after acute
myocardialinfarction. N Engl J Med. 2004;351:2481–8.
8 Buxton AE, Lee KL, Fisher JD, et al. A randomized study of the prevention of sudden death in patients with coronary artery
disease. N Engl J Med. 1999;341:1882–90.
9 Kadish A, Dyer A, Daubert JP, et al. Defibrillators in Non-Ischemic Cardiomyopathy Treatment Evaluation (DEFINITE)
Investigators (2004) Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med.
2004;350:2151–8.
10 Bardy GH, Lee KL, Mark DB, et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators (2005) Amiodarone
or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005;352:225–37.
11 Maron BJ, Gardin JM, Flack JM, et al. Prevalence of hypertrophic cardiomyopathy in a general population of young adults:
echocardiographic analysis of 4111 subjects in the CARDIA study. Circulation. 1995;92:785–9.
12 Maron BJ, Shen W-K, Link MS, et al. Efficacy of implantable cardioverter-defibrillators for the prevention of sudden death in
patients with hypertrophic cardiomyopathy. N Engl J Med. 2000;342:365–73.
13 Maron BJ, McKenna W, Danielson GK, et al. ACC/ESC clinical expert consensus document on hypertrophic cardiomyopathy: a
report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents and the European Society of
Cardiology Committee for Practice Guidelines (Committee to Develop an Expert Consensus Document on Hypertrophic
Cardiomyopathy). J Am Coll Cardiol. 2003;42:1687–713.
14 Brugada P, Brugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical
and electrocardiographic syndrome: a multicenter report. J Am Coll Cardiol. 1992;20:1391–6.
15 Priori SG, Napolitano C, Gasparini M, et al. Natural history of Brugada syndrome: insights for risk stratification and
management. Circulation. 2002;105:1342–7.
16 Chiang CE, Roden DM. The long QT syndrome: Genetic bases and clinical implications. J Am Coll Cardiol. 2000;36:1–12.
17 Haverkamp W, Rolf S, Eckardt L, et al. Long QT syndrome and Brugada syndrome. Drugs, ablation or ICD? Herz. 2005;30:111–
8. Review.
18 Priori SG, Napolitano C, Schwartz PJ, et al. Association of long QT syndrome loci and cardiac events among patients treated with
betablockers. JAMA. 2004;292:1341–4.
19 Nunain SO, Roelke M, Trouton T, et al. Limitations and late complications of third-generation automatic cardioverter-
defibrillators. Circulation. 1995;91:2204–13.
20 Schaer BA, Sticherling C, Osswald S. What are the professional and logistic demands to appropriately follow patients with an
implantable cardioverter-defibrillator? J Intern Med. 2006;260:88–92.
1
/
5
100%