PARTIE_3._Les_reactions_chimiques - icampus

BLOC 1-UE S1 410
Partie 3 –La réaction chimique Page 1
Cours de chimie et didactique
Partie 3. Les réactions chimiques
1 APPROCHE QUALITATIVE DE LA REACTION CHIMIQUE ...................................................................... 2
1.1 Programmes et difficultés des élèves .........................................................................................................................2
1.2 Classement des phénomènes ..........................................................................................................................................4
1.3 Les phénomènes chimiques ............................................................................................................................................6
1.4 Les niveaux de savoirs .......................................................................................................................................................8
1.5 Réaction chimique et équation chimique.............................................................................................................. 10
1.6 Une histoire pleine de rebondissements ................................................................................................................ 20
1.7 Réactions de dissociation et de neutralisation ................................................................................................... 25
1.8 Approche systémique d’une réaction chimique .................................................................................................. 30
2 APPROCHE QUANTITATIVE DE LA RÉACTION CHIMIQUE ................................................................ 31
2.1 Concentration des solutions ........................................................................................................................................ 31
2.2 Grandeurs utiles pour l’étude quantitative .......................................................................................................... 32
2.3 La mole, quantité de matière ...................................................................................................................................... 35
2.4 Masse molaire .................................................................................................................................................................... 36
2.5 Volume molaire des gaz ................................................................................................................................................ 37
2.6 Problèmes stœchiométriques ..................................................................................................................................... 41
3 EXERCICES ......................................................................................................................................................... 47
3.1 Les solutions aqueuses ................................................................................................................................................... 47
3.2 Utilisation du vocabulaire adéquat ......................................................................................................................... 48
3.3 Caractérisation de phénomènes… ............................................................................................................................ 51
3.4 Maitrise de la nomenclature ....................................................................................................................................... 54
3.5 Classement de phénomènes ......................................................................................................................................... 55
3.6 Approche qualitative des phénomènes chimiques ............................................................................................ 57
3.8 Préparation de solutions .............................................................................................................................................. 59
3.9 Modélisation de solutions ............................................................................................................................................. 60
3.10 Calculs de grandeurs ...................................................................................................................................................... 62
3.11 Calculer la quantité de produits formés ................................................................................................................ 64
3.12 Calculer la quantité de réactifs nécessaire ........................................................................................................... 65
3.13 S’entraîner encore un peu… ........................................................................................................................................ 67
4 TACHES ISSUES D’EXAMENS ........................................................................................................................ 69
6 SYNTHESE .......................................................................................................................................................... 75
7 A SAUVEGARDER ............................................................................................................................................. 77
7.1 PREREQUIS
.................................................................................................................................................................... 77
7.2 Objectifs spécifiques à ce chapitre ............................................................................................................................ 78
Didactique, Très important, Laboratoire, Exercice, Pour info

BLOC 1-UE S1 410
Partie 3 –La réaction chimique Page 2
1 APPROCHE QUALITATIVE DE LA REACTION CHIMIQUE
1.1 Programmes et difficultés des élèves
Dans ce chapitre, nous allons aborder la notion de réaction chimique : approche qualitative et
quantitative. Commençons par la découverte des référentiels de compétences et des difficultés
des élèves afin de développer des stratégies efficaces.
Référentiels de compétences :
1. Observer les référentiels de Transition Générale à propos de
la réaction chimique.
Relève en vert les points communs entre les référentiels de sciences
générale (5h) et en sciences de base (3h). Identifie en rouge, les
différences.
2. Lister les concepts à maitriser pour enseigner la réaction
chimique
Choix des approches didactiques : Lire le début de la revue ASTER 18, de la page 1 à 7 sur
Icampus dans la partie didactique et lister les difficultés des élèves et des solutions
didactiques possibles.
Référentiel sciences de base
ICAMPUS :
B1_S410 Didactique :
Aster 13 réaction
chimique

BLOC 1-UE S1 410
Partie 3 –La réaction chimique Page 3
Référentiel Sciences générales

BLOC 1-UE S1 410
Partie 3. La réaction chimique Page 4
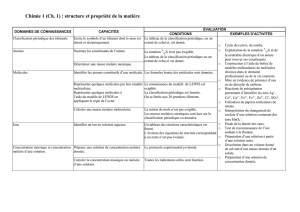
1.2 Classement des phénomènes
1.2.1 Dissolution et transformation chimique
Laboratoire n°8 Mélange ou réaction chimique
Après avoir expérimenté, formulé des hypothèses, vérifié ces hypothèses, on peut
CONCEPTUALISER: produire un concept, faire abstraction de la réalité pour concevoir un
phénomène plus général.
1.2.2 La dissolution, un phénomène physique
Au cours de laboratoire, vous avez réalisé une dissolution du sel. L’interaction entre le sel et
l’eau a produit un mélange incolore de saveur salée : une solution aqueuse de chlorure de sodium.
En ce cas, il y a eu une dissolution du sel dans l’eau. La vaporisation de ce mélange a permis de
séparer le sel et l’eau.
Mélange
Le tableau ci-dessous présente la composition et les propriétés d’un mélange au niveau
macroscopique et au niveau microscopique (niveau atomique, sub-microscopique)
Mélange
d’un point de vue macroscopique
du point de vue microscopique
Association de corps purs qui possède des propriétés
dépendant des corps qui le constituent et de leurs
proportions.
Association de particules de types différents.
Exemple : la solution de chlorure de cuivre II est une
solution translucide de couleur bleue dont l’intensité
de la couleur dépend de la concentration du chlorure
de cuivre dans l’eau.
Figure 1: CuCl2 (NM)
Exemple : la solution de chlorure de cuivre
contient des ions de cuivre, des ions de chlorure
ainsi que des molécules d’eau.
Figure 2: CuCl2 aqueux (NM)
Une solution est donc un mélange homogène d'un soluté et d’un solvant. Le soluté est le corps
qui se trouve en plus petite quantité et le solvant est le corps qui se trouve en plus grande
quantité. On parle de solution aqueuse lorsque le solvant est de l’eau.
Le soluté peut être de différentes natures et plus ou moins soluble dans l’eau. Les
mécanismes de dissolution sont également variés : les molécules peuvent simplement se
dissocier en ions, peuvent réagir avec l’eau ou faire des liaisons intermoléculaires avec l’eau.
Ces mécanismes seront abordés plus en profondeur dans la partie 5 de ce cours.

BLOC 1-UE S1 410
Partie 3. La réaction chimique Page 5
1.2.3 Les phénomènes physiques
Les phénomènes chimiques et physiques sont parfois difficiles à différencier car il est difficile
de saisir en quoi consiste la transformation que nous observons. Le sucre semble disparaitre
dans l’eau tout comme le calcaire semble disparaître dans le vinaigre. Pourtant, ce sont là des
phénomènes bien différents : le premier est une dissolution, un phénomène physique au même
titre que les changements d’état. Tandis que le second est un phénomène chimique.
Phénomène physique
d’un point de vue macroscopique
du point de vue microscopique
Transformation apparente de la matière sans qu’il y
ait de modification de sa nature.
Le corps possède toujours les mêmes propriétés
chimiques.
Association de particules sous une forme
différente de celle de départ mais sans
changement de leur nature.
Exemple : les dissolutions, les mélanges et les
changements d’états
Exemple : l’eau qui s’évapore est toujours de l’eau,
la glace est de l’eau sous forme solide…
Illustration : Miseur L., « Distinction phénomènes physiques et phénomènes chimiques », la
chimie.net (en ligne), http://www.lachimie.net/index.php?page=3#.WI-kpxh7QRE
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
1
/
79
100%