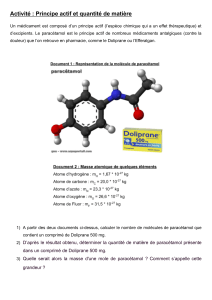
Résumé de cours

Sport, chapitre 16 Seconde
Monsieur Fontaine Page 1 sur 1 Résumé de cours
La mole et la concentration molaire
I - La mole :
Pour faciliter le décompte des entités microscopiques, on les regroupe en «paquets» d'un très
grand nombre constant d'entités identiques : c'est la mole, unité de la quantité de matière.
Une mole d'entités identiques est la quantité de matière d'un système contenant
23
A
10.02,6=N
entités. Le nombre
-123
A
mol10.02,6N = s'appelle la constante d'Avogadro.
A
N
N
n=
n est la quantité de matière en mol
N est le nombre d’entités micrsocopiques.
II - Masses molaires :
La masse molaire d'un atome est la masse d'une mole d'atomes de cet élément. Notée M, elle
s'exprime en
-1
mol.g
. Les valeurs des masses molaires atomiques des éléments figurent dans
la classification périodique.
M
m
n=
m est la masse en g
M
Vρ
n
×
=
V est le volume en L
ρ est la masse volumique en g.L
-1
III – Concentration molaire :
V
n
C=
C est la concentration molaire en mol.L
-1
CMC
m
×
=
C
m
est la concentration massique en g.L
-1
Pour une dilution, on a également
2211
V×C=V×C
1
/
1
100%