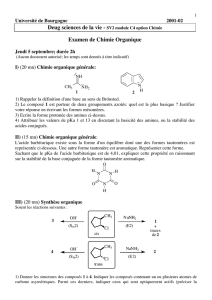
Les Alcools - Cours de chimie générale

Les Alcools

∙ SN avec H2O ou OH- sur halogénoalcanes
∙ Réduction des aldéhydes, cétones, acides, esters (H-)
∙ Addition d'organométalliques sur aldéhydes, cétones
∙ Addition d'eau sur alcènes (hydroboration, oxyHg, ...)
∙ Ouverture des époxydes
∙ Hydrolyse d'esters ( alcool + acide)
∙∙∙∙
I. Modes de préparation des alcools

∙ Les mécanismes permettent de prévoir l'issue
d'une réaction.
∙ Il faut lier les réactions entre-elles, s'entraîner à
réaliser des chemins synthétiques en plusieurs
étapes.
∙ L'analyse rétrosynthétique simplifie les problèmes
de synthèse.
∙ Traquenards dans les plans de synthèse et
solutions possibles.
II. Alcools plus complexes
stratégie de synthèse

Ex 1: Qu'arrive-t-il lorsqu'on ajoute du I- à FCH2CH2CH2Br?
Différence d'aptitude nucléofuge...
Ex 2: De quelle manière un réactif de Grignard s'additionne-t-
il à un groupe carbonyle?
Polarisation des liaisons du substrat et du réactif...
Ex 3: Quel sera le produit qui émergera de l'halogénation
radicalaire du méthylcyclohexane?
Sélectivité du réactif vis-à-vis des forces de liaisons C-H
primaires, secondaires ou tertiares.
Comment prédire l'issue d'une réaction?

Br
a) ClCH2CH2CH2C(CH3)2 + CH3CH2OH
CH2Cl
b) ClCH2CH2CH2C(CH3)2 + (CH3)3CO-+K
OH
c) HOCH2CH2CH2C(CH3)2
Prédire et expliquer l'issue de chaque réaction
ci-dessous sur des bases mécanistiques.
(CH3)3COH
PCC, CH2Cl2
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
1
/
54
100%