G19-20 D.DEVYS Cours du 04/10/2012 de 16h30 à 18h30 M1

G19-20 1/5
G19-20 D.DEVYS
Cours du 04/10/2012 de 16h30 à 18h30
M1 Physiopathologie
__________________________________________________________________________
Inactivation Du Chromosome X
Ce cours se lit en parallèle du power point du même cours. J’y ai ajouté ce qu’a dit le prof en
passant le PPT pour aider à comprendre les diapo.
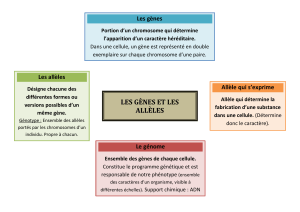
I. LES MECANISMES D’INACTIVATION DU X
Diapo2. L’inactivation d’un des X chez la femme permet une égalisation entre l’homme et la
femme de la transcription des protéines au niveau des chromosomes X. Si il n’y avait pas
cette inactivation il y aurait 2 fois plus de protéines transcrites chez la femme que chez
l’homme (car femme XX et homme XY).
Diapo3. En réalité, c’est plus compliqué.
Chez la femme normale, un X est inactivé et l’autre est actif, permettant la synthèse de
protéines.
Or, si on prend l’exemple d’une femme présentant un syndrome de Turner XO ou un homme
Klinefelter 47 XXY, ils présentent tous deux un phénotype anormal, il y a donc une
contradiction. Comment peut-on l’expliquer ?
Diapo4.On voit ici que le chromosome Y est plus petit en taille que le X (ne représente que
1.8% du génome contre 5.3% pour le X).
Le X comporte de nombreux gènes très variés et portant des fonctions essentielles pour la
survie de l’individu.
Le Y en plus d’être plus petit que le X comporte un nombre de gènes moins important que ce
qui ne serait attendu par rapport à sa taille. En effet, il possède une région dite « inerte » ou
il n’y a aucune activité transcriptionelle : hétérochromatisation de cette partie du
chromosome Y. Il possède tout de même certains gènes importants pour le développement
sexuel (ex : SRY) et certains exprimés dans le testicule avec fonction spécifique.
Un certain nombre de gènes sont communs aux X et Y : gènes homologues à ces 2
chromosomes. Cela nous prouve l’origine commune des chromosomes X et Y (ancêtre
commun et dégénérescence du Y avec moins de gènes).
Diapo5.Ces régions homologues sont appelées les régions « pseudoautosomales ». 2 sont
importantes et situées aux extrémités des bras courts et longs des chromosomes.
Ce sont des régions essentielles pour la méiose chez l’homme : l’appariement entre le
chromosome X et Y se fait grâce à ces régions.
Rq : le gène SRY situé au niveau du bras court juste à coté de la région pseudoautosomale
peut être intriqué dans des recombinaisons anormales lors de l’aparariement mais c’est rare.
Il existe d’autres régions homologues entre le chromosome X et Y avec quelques gènes
homologues (ex : RPS4Y).
Les gènes des régions pseudoautosomales et homologues échappent aux mécanismes de
l’inactivation et il y a expression des gènes de ces zones en bleu sur le schéma.

G19-20 2/5
Diapo6. Le mécanisme d’inactivation est dit épigénétique c’est-a-dire que la séquence
nucléotidique ne change pas, elle est conservée lors de la mitose et méiose ms il y a une
régulation de l’expression ou non des gènes. Dans ce cas il y a inactivation de l’expression
des gènes : pour cela le chromosome X qui va être inactivé passe d’un état d’euchromatine
active à un état d’hétérochromatine très condensée à la différence du chromosome X actif.
Diapo7. On a donc dit précédemment que chez l’Homme, il y avait inactivation d’un des
deux X pour qu’il y ait compensation du dosage génique chez l’homme et la femme
(égalisation de la production des gènes par le chromosome X). Chez les autres espèces il y
a également cette compensation mais elle se fait par d’autres mécanismes. Exemples de
la drosophile et de C.elegans (XO= hermaphrodite).
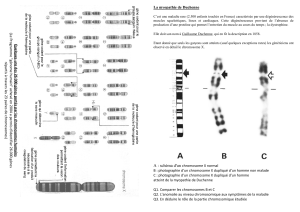
Diapo8. Comment a-t-on découvert l’inactivation du X ?
La première indication de l’inactivation du X a été fournie par le neuroanatomiste Dr Barr en
1949. Il étudiait la comparaison entre l’anatomie du chat mâle et femelle et a découvert dans
les neurones de chat femelle une structure non présente chez les males : le corpuscule de
Barr (à droite sur la diapo).
Puis en 1961, Mary Lyon étudiât une race de chat particulière : le chat Calico. Chez les
femelles, il y a coexistence de taches noires et oranges alors que les males ont soit une
coloration noire homogène soit orange homogène : cela correspond à 2 allèles différents
d’un même gène situé sur le chromosome X. Pour chaque cellule suivant le chromosome X
inactivé (au hasard) on aura la coloration orange ou noire chez la femelle donc un chat
tacheté alors que le male n’a qu’un seul X donc une coloration noire ou orange homogène.
A partir de cette analyse plusieurs hypothèses ont été formulé qui se sont toutes révélées
juste (cf. diapo.)
Diapo9.Cette inactivation se fait pendant l’embryogenèse, au stade blastocyste. Il y a
ensuite transmission clonale avec le même profil d’inactivation.
Photo en bas à droite : pour exemple, souris transgéniques exprimant la GFP (Green
Fluorescent Protein) à partir du chromosome X. Chez les femelles, il y a une mosaïque, les
males sont homogènes.
Diapo10. Les femmes sont en fait des mosaïques avec la moitié des cellules exprimant les
gènes du X paternel et la moitié exprimant les gènes localisés sur le X maternel.
Exemple d’une pathologie rare (pas à retenir) : la dysplasie ectodermique anhidrotique.
Mutation du gène EDA1 sur chromosome X. Donne un défaut de développement des
glandes sudoripares, des cheveux, des dents. Très sévères chez les hommes avec absence
de sudation et crises hyperthermiques mortelles. Les femmes ont des symptômes à minima
quelques fois : il y a des endroits de la peau ou elles n’ont pas de glandes sudoripares.
Diapo11. Dans chaque cellule, il y a un contage du nombre de chromosomes X par rapport
au nombre de chromosomes autosomes. Il y a toujours un chromosome X actif pour 2*22
autosomes, tous les autres X sont inactivés dont :
Femme Turner ou homme : pas d’inactivation
Femme normale ou homme Klinefelter : un X inactivé
Femme Triple X : 2 X inactivés
Femme Quadruple X : 3 X inactivés
Diapo12. Pour arriver à initier l’inactivation d’un chromosome X il faut un traitement différent
des 2 chromosomes homologues. La cellule choisit d’inactiver 1 des 2.
4 étapes (cf. diapo).
« en cis » signifie « sur l’ensemble du chromosome » qu’on va inactiver.

G19-20 3/5
Diapo13. Etude de l’inactivation chez des souris
Schéma de gauche : Les mécanismes sont qqs peu différents que chez l’Homme : en effet,
chez la souris il y a une inactivation dite « soumise à empreinte » c’est-à-dire que
l’inactivation se fait toujours que le chromosome X paternel. Il y a ensuite formation du
blastocyste. Dans la masse cellulaire interne de ces blastocystes, il y a réversion de cette
inactivation soumise à empreinte. La masse interne correspond au futur embryon avec les 2
chromosomes X actifs. Ensuite survient comme chez l’Homme ce phénomène d’inactivation
du chromosome X au hasard : elle est transmise de façon clonales dans toutes les cellules
puis réactivation dans les cellules germinales primordiales.
Ce phénomène d’inactivation a lieu juste dans les cellules de la masse cellulaire interne,
cellules pluripotentes qui donneront l’ensemble des cellules de l’embryon. Le
trophectoderme en périphérie, qui donnera les annexes est toujours soumise à empreinte (il
n’y a pas eu réversion puis inactivation au hasard) donc dériveront toutes du chromosome
paternel.
Schéma de droite : On peut induire l’inactivation in vitro en prenant des cellules souches de
l’embryon de souris (masse cellulaire interne) et en ajoutant par exemple de l’acide
rétinoïque : il y a une différenciation des cellules avec inactivation du X. On reproduit les
mécanismes d’inactivation.
Diapo14. Le prof est passé dessus sans la commenter
Diapo15. Pour mettre en place l’inactivation du X, une région unique est indispensable : la
région XIC.
On l’a identifié par des études de translocations et délétions qui ont montré que :
- la région XIC était nécessaire pour initier l’inactivation en cis de l’ensemble du chromosome
X
- pour cette inactivation 2 régions XIC sont nécessaires (s’il y en a qu’une pas d’inactivation).
Diapo16. On sait que cette région XIC joue un rôle dans les mécanismes de comptage. On a
démontré par hybridation in situ –technique FISH (sondes de peinture permettant
l’identification des régions XIC) l y a une interaction transitoire entre les 2 régions XIC : « XIC
kissing ».
Diapo17. L’étude de la région XIC a montré qu’il se trouvait dans ce centre un gène clé : le
gène XIST. Il n’est transcrit qu’à partir du chromosome X. Il est transmis aux 2 chromosomes
à taux faible puis retrouvé uniquement dans le X inactivé : c’est le seul gène qu’on trouve
spécifiquement sur le chromosome X inactif : expression monoallélique.
Ce gène XIST code pour de l’ARN nucléaire de grande taille (environ 18000 paires de
bases), polyadenylé et retenu dans le noyau. Cet ARN n’est pas codant, il n’y aura pas de
synthèse de protéines a partir de celui-ci.
Diapo18. Comment fonctionne le gène XIST ?
L’ARN du gène XIST est produit en grande quantité et recouvre le chromosome X. Il ne
recouvre que le futur chromosome inactif (il ne reconnait des séquences que sur le futur
chromosome inactif).
Diapo19. Cellules ES= embryonnaires souches. On voit bien que au début le gène XIST est
visualisé sur les deux chromosomes X puis à la fin on ne le retrouve plus que dans l’inactif.
Diapo20. Sur l’autre brin d’ADN à coté du gène XIST se trouve un gène qui est anti-sens à
XIST : TSIX. Sur le chromosome actif : il y a persistance de TSIX qui réprime XIST. Sur le
chromosome inactif : il y a diminution de l’expression de TSIX donc expression de XIST et
inactivation du chromosome.

G19-20 4/5
Diapo21. Comme dit précédemment, XIST est nécessaire à l’inactivation du chromosome X.
Comment agit-il ? Il permet une compartimentalisation du chromosome X à inactiver.
Il n’est pas nécessaire à la maintenance de cette inactivation : si on prend des cellules
embryonnaires souches ou XIST est exprimé, il y a inactivation mais si on inactive XIST plus
tardivement, l’inactivation du chromosome X persiste.
RQ/Rappel : Les protéines d’histones sont basiques, ce qui permet une interaction avec
l’ADN spécifiquement. Les histones en octamères et l’ADN interagissent et forment des
nucléosomes: on retrouve un cœur globulaire composé d’histones empactés entouré d’un
ADN double brin. L’acétylation et la méthylation se fait sur les queues N-term des histones
qui sortent du nucléosome.
Il y a une modification de chromatine du chromosome X à inactiver : hétérochromatisation
qui se fait par différents mécanismes : cf. diapo en gras. Cela permet l’inaccessibilité à la
machinerie transcriptionelle (hypoacétylation, méthylation, condensation.)
RQ/Rappel : Les dinucléotides CG sont des points chauds de mutation. Leur fréquence est
de ¼ dans le génome (car surmutation) à la différence des AG par exemple : 1/16.
Ces dinucléotides CG sont méthyles dans le génome par une CpG-méthylase à l’exception
de certaines régions : les ilots CpG. Ils se trouvent par exemple au niveau de promoteurs
d’un grand nombre de gènes : cela a un rôle dans la régulation de l’expression des gènes.
L’exception est la méthylation de ces dinucléotides CG dans le chromosome X inactif pour la
répression de l’expression des gènes et le remodelage de la chromatine (formant le
corpuscule de Barr).
Diapo22. Des régions de XIST sont nécessaires pour la répression transcriptionelle : région
de répétitions A (appelé ainsi sans rapport avec adénine) et d’autres pour le recrutement de
facteurs de modification de la chromatine.
Diapo23. Au départ on a 2 chromosomes X actifs. A partir d’un des deux, il y a expression
de XIST qui va permette la formation d’un compartiment chromatinien. Rapidement, il y a
exclusion de la machinerie transcriptionelle et inactivation du X. Les seuls gènes échappant
à cette inactivation sont ceux situé à la périphérie du territoire chromatinien.

G19-20 5/5
II. ETUDE DE L’INACTIVATION DU X
Diapo1. Sur le X actif il n’y a pas de méthylation à la différence du X inactif.
On utilise donc des enzymes HpaII de restriction sensibles à la méthylation : s’il y a de la
méthylation elles coupent à ce niveau si non elles ne coupent pas.
Puis on étudie les fragments par PCR. Si l’enzyme a coupé il n’y a pas d’amplification, si elle
n’a pas coupé il y a amplification.
Puis on fait de la PCR semi-quantitative pour voir le ratio Xactif/Xinactif
Diapo2.Pour différencier les 2 chromosomes X, on utilise des microsatellites : répétitions de
di ou trinucléotides.
Le nombre de répétitions varient d’un chromosome à l’autre et on peut ainsi les différencier.
On utilise 2 marqueurs différents : HUMARA et FMR dont respectivement 90% et 80% des
femmes sont hétérozygotes.
Le ratio attendu est 50/50 puisque l’inactivation se fait au hasard.
Diapo3, 4,5. Apres amplification, on met le tout sur un séquenceur pour avoir des pics et
ainsi voir le ratio entre Xactif et Xinactif.
Diapo6. L’inactivation se fait au hasard donc on attend un ratio 50/50. Il peut y avoir des
variations. Si on analyse un grand nombre de femmes on s’aperçoit qu’il y a une répartition
gaussienne : en général 50/50 mais certaines avec un biais relatif.
8% de la population générale féminine ont une distribution ave un ratio 80/20 et ce biais
augmente avec l’âge. Jusque 80/20, on considère qu’il n’y a pas de biais significatif, au de la
si : modéré jusque 90/10 et important au-delà.
Diapo7. Dans quels cas trouve-t-on des biais ? 2 types : primaires et secondaires cf. diapo
Diapo8, 9, 10, 11, 12, 13, 14, 15,16. Exemples de biais primaires et secondaires avec
conséquences comme dans la maladie de Duchenne (diapo17).
Le prof est passé plus rapidement sur ces dernières diapos car il n’avait plus trop de temps.
1
/
5
100%