TRANSFORMATIONS FORCÉES : ELECTROLYSES (correction)

Terminale S – Chimie TP n°7
TRANSFORMATIONS FORCÉES : ELECTROLYSES (correction)
Objectifs
Mise en évidence expérimentale de la possibilité, dans certains cas, de changer le sens d’évolution d’un
système.
Effectuer un bilan qualitatif et quantitatif d'une électrolyse.
1 – Les couples Zn 2+ / Zn et I2 / I –
1.1 – Recherche de l’évolution spontanée
Réactifs disponibles : poudre de zinc ; solution de sulfate de zinc de concentration 1.10–2 mol.L –1 ; eau iodée de
concentration 1,0.10–2 mol.L -1 ; solution d’iodure de potassium de concentration 1.10–2 mol.L –1 ; soude.
1. Déterminer expérimentalement le sens d’évolution spontané entre les espèces des 2 couples étudiés. Décrire
avec soin le protocole utilisé.
Parmi les espèces des deux couples redox considérés, la seule réaction envisageable est celle entre un oxydant et un
réducteur, c’est-à-dire entre Zn2+(aq) et I–(aq) ou bien entre I2(aq) et Zn(s). Testons ces deux possibilités.
Dans la 1ère expérience, aucune transformation n’est visible.
Dans la 2nde expérience, on observe une décoloration de l’eau iodée : c’est donc qu’I2(aq) a réagi. La décoloration
observée suggère la « disparition » de I2(aq), seule espèce colorée ici. Cette espèce oxydante aurait dû réagir avec le
réducteur d’un autre couple redox, en l’occurrence Zn(s). S’il n’avait pas été introduit en trop grande quantité, on peut
effectivement constater la « disparition » du zinc solide ; l’ajout de quelques gouttes de soude donne un précipité
blanchâtre plus marqué après réaction que sur 10 mL de sulfate de zinc : des ions Zn2+(aq) se sont donc formés.
Spontanément, le diiode I2(aq) oxyde donc le zinc Zn(s), mais l’ion zinc(II) Zn2+(aq) n’oxyde pas l’ion iodure I–(aq).
2. Ecrire l'équation de la réaction associée à cette transformation chimique spontanée.
Spontanément, le diiode est réduit et le zinc oxydé :
I2(aq) + 2 e–= 2 I–(aq)
Zn(s) = Zn2+(aq) + 2 e–
I2(aq) + Zn(s) = 2 I–(aq) + Zn2+(aq)
3. Par un calcul de quotient de réaction initial, montrer que le sens d’évolution trouvé est bien celui
prévisible théoriquement.
La constante de cette réaction spontanée est K = 6.1046. Or, dans la 2ème expérience,
2
2
,
2 2
( ) ( ) 00
( ) ( )
i i
r i
i i
Zn aq I aq
Q K
I aq I aq
10 mL I2(aq) 1.10
–
2
mol/L
(eau iodée)
poudre Zn(s)
10 mL Zn
2+
(aq) + SO4
2
–
(aq) 1.10
–
2
mol/L
10 mL K+(aq) + I–(aq) 1.10–2 mol/L
Exp. 1
Exp. 2

2
puisque Zn2+(aq) et I–(aq) ne sont initialement pas présents.
D’après le critère d’évolution spontanée, la transformation s’effectue donc dans le sens direct, qui est celui de
formation des ions iodure I–(aq) et des ions zinc(II) Zn2+(aq).
4. Que peut-on dire du taux d’avancement final de la réaction ?
La constante de réaction K est très supérieure à 103: la réaction est donc totale, et le taux d’avancement final
de la réaction vaut 1.
2 – La transformation forcée
1. La réaction inverse est-elle susceptible de se produire ? Calculer sa constante d’équilibre. Conclure.
La réaction considérée précédemment étant totale, sa réaction inverse ne se produit pas : l’équilibre est
totalement déplacé vers la droite. La réaction inverse
2 I–(aq) + Zn2+(aq) = I2(aq) + Zn(s)
a une constante K’ extrêmement faible,
247
246
2
( ) 1 1
' 2.10 1
6.10
( ) ( )
éq
éq éq
I aq
KK
Zn aq I aq
Cette réaction est donc effectivement extrêmement limitée.
2. Est-il possible de forcer ce système à évoluer dans le sens de la formation de zinc et de diiode ?
La constante de réaction ne dépend pas des conditions initiales : ce n’est pas en jouant sur les concentrations
initiales qu’on pourra favoriser la réaction inverse. La très grande valeur de K laisse supposer que nous ne
pouvons pas non plus agir sur la température.
Toutefois, nous parlons d’oxydo-réduction : la réaction spontanée s’explique par un transfert spontané
d’électrons,
I2(aq) + Zn(s) = 2 I–(aq) + Zn2+(aq)
La réaction inverse implique un transfert non spontané
2 I–(aq) + Zn2+(aq) = I2(aq) + Zn(s)
que l’on pourrait essayer d’imposer : l’oxydation des ions iodure et la réduction des ions zinc(II) pourrait
avoir lieu si l’on agissait sur le transfert d’électrons entre les couples en le forçant à l’aide d’un générateur :
c’est le principe de l’électrolyse, où la circulation des électrons est imposée par le générateur électrique
externe au système chimique.
a - Expérience
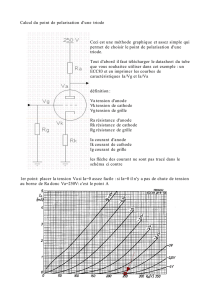
Réaliser le montage suivant :
Ajuster la tension aux bornes du générateur à 15 V.
Fermer l’interrupteur.
Observer les électrodes et l’aspect de la solution
autour de celles-ci.
Introduire 2 mL de cyclohexane du coté où un
phénomène coloré se produit et observer.
b – Exploitation
1. Qui impose le sens de déplacement des porteurs de charge ?
Electrodes en graphite
+
–
cathode
anode
solution
d’iodure
de zinc(II)
tube en U
perte de 2 e
–
gain de 2 e
–
perte de 2 e
–
gain de 2 e
–

3
Ici, les électrons sont contraints à se déplacer depuis la borne (–) du générateur et vers la borne (+) du
générateur à l’extérieur de celui-ci. C’est la différence de potentiel assurée par le générateur qui impose ces
sens de déplacement.
2. Reproduire le schéma du montage électrique et y faire figurer le sens de déplacement de tous les
porteurs de charge et celui du courant électrique imposé.
3. Proposer une interprétation des phénomènes observés aux électrodes.
Comme indiqué sur le schéma, la formation de la couleur brune à l’anode atteste de la formation de diiode
I2(aq) ; on s’en convainc avec le cyclohexane, qui solubilise cette espèce en donnant une couleur fuchsia
caractéristique. Un dépôt gris-blanc se forme sur la cathode : il s’agit probablement de zinc métallique.
4. Ecrire les demi-équations se produisant à chaque électrode. Préciser leur nature.
Anode, siège de l’oxydation 2 I–(aq) = I2(aq) + 2 e–
Cathode, siège de la réduction Zn2+(aq) + 2 e– = Zn(s)
5. Ecrire l'équation globale associée à la transformation électrochimique réalisée.
Zn2+(aq) + 2 I–(aq) = Zn(s) + I2(aq)
6. Comment évolue le quotient de réaction au cours d’une telle transformation ?
Le quotient de réaction s’écrit
2
2
2
( )
( ) ( )
r
I aq
Q
Zn aq I aq
Initialement,
2
,2
2
( )
0
( ) ( )
i
r i
i i
I aq
Q
Zn aq I aq
car le diiode n’est pas encore apparu
Le quotient de réaction augmente au cours de la transformation
puisqu’il se forme du diiode. Comme K = 2.10–47 est très faible, Qr va
très vite dépasser la valeur de K : contrairement à se qui se passe pour
les réactions spontanées, le quotient de réaction s’éloigne de K ! Ici, la
transformation globale n’est pas spontanée, mais provoquée par le
générateur. On dit qu’elle est forcée.
+
i
I
–
(aq)
I2(aq)
Zn
2+
(aq)
Zn(s)
anode
oxydation des ions I–(aq)
cathode
réduction des ions Zn2+(aq)
e
–
e
–
e
–
e
–
e
–
e
–
S
olution
Zn
2+
(aq) + I
–
(aq)

4
2 – Aspect quantitatif d'une électrolyse : électrolyse de l'eau en milieu acide
2.1 - Expérience
Introduire 100 mL d'eau distillée dans l'électrolyseur. Remplir les
éprouvettes graduées avec de l'eau distillée et les retourner, sans bulles
d'air, sur les électrodes.
Ajouter 10 mL d'acide sulfurique à 2 mol.L-1 dans la cuve de
l'électrolyseur.
Homogénéiser la solution à l'aide d'un agitateur et ce, particulièrement
entre les électrodes.
Réaliser le montage en série comprenant : un générateur de tension
continue réglable, un électrolyseur, un multimètre utilisé en mode
ampèremètre, un interrupteur.
Fermer l'interrupteur tout en déclenchant le chronomètre et ajuster la
tension aux bornes du générateur pour que l’intensité du courant soit de
l’ordre de 0,3 A.
→ Observer.
Arrêter l’électrolyse lorsque le volume le plus grand dégagé à une
électrode vaut environ 10 mL.
→ Estimer le volume de gaz dégagé à l'autre électrode.
→ Identifier les gaz formés.
Lorsque le volume le plus grand est atteint à l’électrode correspondante, le volume de gaz dégagé à l’autre
électrode est deux fois plus petit.
En approchant une allumette allumée de l’éprouvette contenant le plus grand volume de gaz, une détonation
se produit : le gaz dégagé est donc du dihydrogène H2(g).
En prenant une allumette tout juste éteinte (incandescence) et en l’approchant du gaz contenu dans le 2ème
éprouvette, l’allumette se rallume : le gaz dégagé est du dioxygène O2(g).
2.2 - Exploitation
Données : couples O2(g)/H2O(l) H+(aq)/H2(g) 2-
2 8
S O (aq)
/2-
4
SO (aq)
2-
4
SO (aq)
/SO2(aq)
Vm = 24 L.mol-1
1. A partir de l'inventaire des espèces chimiques présentes dans la solution et du sens de circulation des
électrons, écrire les équations de réaction possibles à chaque électrode.
Dans le milieu réactionnel, à l’état initial, les espèces présentes sont : H2O(l), H+(aq) et SO42–(aq).
Oxydations possibles à l’anode
2 H2O(l) = O2(g) + 4 H+(aq) + 4 e–
2 SO42–(aq) = S2O82–(aq) + 2 e–
Réductions possibles à la cathode
2 H+(aq) + 2 e– = H2(g)
SO42–(aq) + 4 H+(aq) + 2 e– = SO2(aq) + 2 H2O(l)
2. Au vu des observations, indiquer les réactions qui se produisent réellement aux électrodes.
Nous avons constaté la formation de deux gaz, H2(g) et O2(g). On peut donc en déduire les réactions aux
électrodes :
à l’anode : oxydation de l’eau 2 H2O(l) = O2(g) + 4 H+(aq) + 4 e–
à la cathode : réduction des ions oxonium 2 H+(aq) + 2 e– = H2(g)
3. Établir l'expression de la quantité d’électrons ayant circulé dans le circuit pendant la durée t en
fonction de l'intensité du courant qui a circulé dans le circuit.
Par définition de l’intensité,
e
n
Q
I
t t
F
A
C
+
A
i

5
où ne est la quantité de matière d’électrons et F le faraday : 1 F = NA × e = 96 500 C.mol–1. On en déduit
e
I t
n
F
4. Établir le tableau descriptif de l'évolution du système à l'anode.
équation de la réaction 2 H2O = O2+ 4 H++ 4 e–
état du système avancement n(H2O) n(O2) n(H+) n(e–)
état initial 0
état
intermédiaire x x xx
état final xf
excès
xfxfxf
5. Vérifier que le volume mesuré expérimentalement est en accord avec la valeur calculée dans les
conditions de l'expérience.
Nous avons fait fonctionner l’électrolyse pendant Δt = 4 min 40 s = 280 s, sous I = 290 mA, ce qui
correspond à un transfert de
4
0,290 280 8,4.10
96500
e
I t
n mol
F
Nous avons mesuré un volume de dioxygène à l’anode de V(O2)f = 5,0 mL. A l’aide du volume molaire Vm =
24 L.mol–1, on obtient
3
24
2
5,0.10 2,1.10
24
f
f
m
V O
n O mol
V
On vérifie bien ici que
2
4
e
f
n n O
comme le prévoit le tableau d’avancement.
6. Écrire l'équation de la réaction associée à l’électrolyse.
2 H2
O(l)
= O2(g) + 4 H+(aq) + 4 e–
2 H+(aq) + 2 e–
= H2(g) (× 2)
2 H2O(l) = 2 H2(g) + O2(g)
Quand bien même nous avons électrolysé une solution aqueuse d’acide sulfurique, l’expérience mérite bien
son nom d’électrolyse de l’eau : dans cette manipulation, l’acide sulfurique joue le rôle d’une solution
électrolytique permettant la conduction électrique (l’eau n’étant pas conductrice du courant).
7. Vérifier que le rapport des volumes dégagés est en accord avec le rapport des quantités de matière à
l'état final.
Expérimentalement, nous avons constaté que
2
2
2
f
f
V H
V O
équation de la réaction 2 H2O = O2+ 2 H2
état du système avancement n(H2O) n(O2) n(H2)
état initial 0
état intermédiaire x x x
état final xf
excès
xfxf
D’après ce tableau,
 6
6
 7
7
 8
8
1
/
8
100%