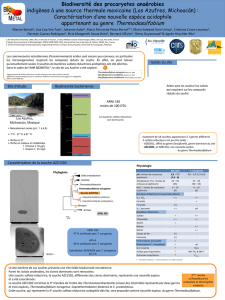
Rôle du périplasme dans la perception par la bactérie de

Université des Sciences et Technologies de Lille
Thèse
Présentée par
Anne-France P
ROUVOST
Pour l’obtention du grade de Docteur de l’Université des Sciences et Technologies de Lille
Discipline : Sciences de la vie et de la santé
Rôle du périplasme dans la perception par la
bactérie de son environnement :
•Utilisation des ȕ-galactanes par Erwinia chrysanthemi
•Voie de signalisation du système Rcs dans la virulence
d’Erwinia chrysanthemi
Soutenue le 22 octobre 2008, devant la commission d’examen composée de :
Président : Jean-Claude M
ICHALSKI
Rapporteurs : Alain F
ILLOUX
Jean-Claude L
AZZARONI
Examinateurs : Jean-Marie L
ACROIX
Anthony P
UGSLEY
Directeur de Thèse : Jean-Pierre B
OHIN
Thèse d'Anne-France Prouvost, Lille 1, 2008
© 2009 Tous droits réservés.
http://doc.univ-lille1.fr

Sommaire
Thèse d'Anne-France Prouvost, Lille 1, 2008
© 2009 Tous droits réservés.
http://doc.univ-lille1.fr

2
.
Sommaire
. Remerciements ................................................................................................................. 7
. Introduction ...................................................................................................................... 9
A. L’enveloppe des protéobactéries.................................................................................... 9
1. L’enveloppe des bactéries .......................................................................................... 9
a) La membrane interne.............................................................................................. 9
• La double couche lipidique ................................................................................ 9
• Les protéines de la membrane interne.............................................................. 10
b) La membrane externe ........................................................................................... 11
• La double couche lipidique .............................................................................. 11
• Les protéines de la membrane externe ............................................................. 12
c) Le périplasme ....................................................................................................... 14
• Le peptidoglycane ............................................................................................ 14
• Les glucanes périplasmiques osmorégulés....................................................... 15
• Les protéines périplasmiques ........................................................................... 15
d) Structures associées à l’enveloppe ....................................................................... 16
• La capsule......................................................................................................... 16
• Les flagelles...................................................................................................... 17
• Les pilis ............................................................................................................ 17
e) Structures traversant l’enveloppe : les systèmes de transport .............................. 18
• Le système Sec ................................................................................................. 18
• Le système TAT ............................................................................................... 19
• Le système de type I : système de type ABC (ATP Binding Cassette)............ 20
• Le système de type II ....................................................................................... 21
• Le système de type III ...................................................................................... 21
• Le système de type IV...................................................................................... 21
• Le système de type V ....................................................................................... 21
• Le système de type VI...................................................................................... 22
2. Pouvoir pathogène, facteurs de virulence, facteurs d’antivirulence......................... 22
a) L’acquisition de gènes de virulence. .................................................................... 22
b) L’élimination de gènes d’antivirulence................................................................ 23
B. Les glucanes périplasmiques osmorégulés : les OPG .................................................. 25
1. Les OPG : structure des familles.............................................................................. 25
a) La famille I ........................................................................................................... 25
b) La famille II.......................................................................................................... 26
c) La famille III ........................................................................................................ 26
d) La famille IV ........................................................................................................ 26
2. Synthèse des OPG chez E. coli et E. chrysanthemi et leur régulation ..................... 28
3. Rôle et impact sur la virulence................................................................................. 31
C. Les systèmes à deux composants et les phosphorelais................................................. 34
1. Structure ................................................................................................................... 34
a) Le capteur............................................................................................................. 34
Thèse d'Anne-France Prouvost, Lille 1, 2008
© 2009 Tous droits réservés.
http://doc.univ-lille1.fr

3
b) Le régulateur ........................................................................................................ 34
c) Les phosphorelais................................................................................................. 35
2. La perception du signal ............................................................................................ 36
3. Le paradigme EnvZ-OmpR...................................................................................... 37
4. Une réponse graduée ................................................................................................ 38
5. Rôle dans la virulence .............................................................................................. 40
D. Le phosphorelais : RcsCDB ......................................................................................... 45
1. RcsCDB.................................................................................................................... 45
a) RcsC ..................................................................................................................... 45
b) RcsD..................................................................................................................... 45
c) RcsB ..................................................................................................................... 45
d) RcsA..................................................................................................................... 47
2. Protéines interagissant avec le phosphorelais Rcs ................................................... 47
a) RcsF...................................................................................................................... 47
b) IgaA...................................................................................................................... 47
c) DjlA...................................................................................................................... 49
3. Autres éléments interagissant avec le phosphorelais Rcs ........................................ 49
4. Les gènes cibles du système Rcs.............................................................................. 50
5. La mutation suppressive rcsC2 ................................................................................ 51
E. Le modèle d’étude : Erwinia chrysanthemi 3937 ........................................................ 53
1. Structure de la paroi de la plante hôte ...................................................................... 53
2. Mécanismes de virulence ......................................................................................... 55
. Objectifs .......................................................................................................................... 60
. Partie I – Contribution à la caractérisation du locus gan impliqué dans l’utilisation
des galactanes chez Erwinia chrysanthemi........................................................................... 61
A. Caractérisation du locus gan chez Erwinia chrysanthemi............................................ 61
1. Identification du locus.............................................................................................. 61
2. Caractérisation du locus : utilisation des galactanes et de leurs dérivés .................. 64
a) Caractérisation des activités galactanases ............................................................ 64
• GanA : l’endo-1,4-ȕ-galactanase...................................................................... 64
• GanB : l’exo-1,4-ȕ-galactanase........................................................................ 67
b) Caractérisation du système de transport des galactanes....................................... 68
B. Régulation des gènes gan............................................................................................. 69
1. Effet de la source de carbone sur l’expression des gènes gan ................................. 69
a) Effet des conditions de culture sur l’expression des fusions transcriptionnelles . 69
b) Effet des conditions de culture sur l’activité endo-1,4-ȕ-galactanase.................. 75
• Effet sur l’activité de GanA ............................................................................. 75
• Effet sur la fusion transcriptionnelle ganA::uidA............................................. 75
c) Effet des conditions de culture sur l’activité exo-1,4-ȕ-galactanase.................... 75
2. Effet de la phase stationnaire sur l’expression des gènes gan.................................. 76
3. Effet de GanR sur l’expression des gènes gan ......................................................... 78
4. Rôle du locus gan dans l’infection de l’hôte............................................................ 79
a) Impact sur la virulence ......................................................................................... 79
b) Expression du locus lors de l’infection ................................................................ 79
Thèse d'Anne-France Prouvost, Lille 1, 2008
© 2009 Tous droits réservés.
http://doc.univ-lille1.fr

4
C. Relation entre le locus gan, les OPG et le système RcsCDB....................................... 81
D. Conclusion et discussion .............................................................................................. 82
. Partie II - Rôle du système à deux composants RcsCDB dans le pouvoir pathogène
d’Erwinia chrysanthemi et lien existant entre les OPG et le système RcsCDB................. 87
A. Impact du système RcsCBD sur le pouvoir pathogène d’Erwinia chrysanthemi. ....... 87
1. Effet des mutations dans le système Rcs (rcsC2, rcsC, rcsD, rcsB, ǻrcsCBD et
rcsF) dans les contextes sauvage et opgG........................................................................ 87
a) Effet des mutations sur la mucosité...................................................................... 89
b) Effet des mutations sur la motilité........................................................................ 89
c) Effet des mutations sur l’activité pectinase.......................................................... 90
d) Effet des mutations sur la résistance aux sels biliaires......................................... 90
e) Effet des mutations sur la virulence ..................................................................... 91
f) Bilan des mutations .............................................................................................. 92
2. Caractérisation de la mutation rcsC2 ....................................................................... 94
a) Effets des mutations sur les fusions transcriptionnelles....................................... 94
• Fusion flhD-uidA .............................................................................................. 94
• Fusion ftsA-uidA............................................................................................... 96
b) La souche rcsC2 opgG ne perçoit plus le choc osmotique .................................. 97
c) Dominance de la mutation rcsC2 ......................................................................... 99
• Clonage du locus rcsCBD ................................................................................ 99
• Phénotype du mérodiploide : opgG, rcsC2, miniTn5rcsCBD ......................... 99
• Test de motilité............................................................................................... 100
• Virulence du mérodiploïde............................................................................. 100
3. Expression d’une version soluble de la lipoprotéine RcsF : TAT-RcsF ................ 101
a) Construction de la version soluble : TAT-RcsF................................................. 101
b) Caractérisation de la structure de la protéine : mutations des cystéines ............ 103
c) Détermination par délétion de la partie active de RcsF...................................... 105
d) Impact des mutations et des délétions dans TAT-rcsF sur l’expression de la
fusion cpsB-lacZ......................................................................................................... 106
e) Surexpression transitoire par le plasmide pNFW177 (contenant TAT-rcsF) chez
E. chrysanthemi.......................................................................................................... 108
4. Effet de la surexpression des gènes TAT-rcsF, igaA, djlA ..................................... 109
a) Surexpression chez E. coli ................................................................................. 109
b) Surexpression chez E. chrysanthemi : phénotypes sur boîte.............................. 109
• La mucosité .................................................................................................... 110
• La motilité ...................................................................................................... 111
c) Surexpression chez E. chrysanthemi : dosage de la fusion ftsA-uidA ................ 112
d) Virulence ............................................................................................................ 113
• Test de virulence sur les tubercules de pomme de terre................................. 113
• Test de virulence sur les feuilles d’endive. .................................................... 115
e) Bilan des surexpressions .................................................................................... 116
B. Relation entre les OPG et le système Rcs .................................................................. 117
1. Construction de p
araBAD
opgGH.............................................................................. 117
2. Effet de la variation de la quantité des OPG .......................................................... 118
a) Sur un des gènes cibles du système Rcs : la fusion ftsA-uidA............................ 118
b) Sur la fusion opgG-uidA..................................................................................... 121
Thèse d'Anne-France Prouvost, Lille 1, 2008
© 2009 Tous droits réservés.
http://doc.univ-lille1.fr
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
1
/
182
100%