Annexe 1 - Rapport ACHIL Impact sur la qualité

Service Etude des Soins de Santé
Rue Juliette Wytsman 14
1050 Bruxelles – Belgique
www.wiv-isp.be
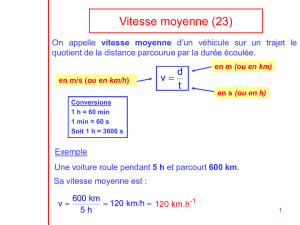
Trajets de soins diabète sucré de type 2 et
insuffisance rénale chronique : impact sur
la qualité des soins
Achil Phase 1 (2009-2013). Ambulatory Care Health Information Laboratory.
ISSN: D/2013/2505/25

2
La Science au service de la Santé publique, de la Sécurité de la chaîne alimentaire et de l’Environnement.
Santé Publique et Surveillance | novembre 2013 | Bruxelles, Belgique
Numéro de référence interne : 2013-019
Numéro de dépôt ou ISSN : D/2013/2505/25
AUTEURS
Viviane VAN CASTEREN
1
, Nathalie BOSSUYT
1
, Sarah MOREELS
1
,
Katrien VANTHOMME
1
, Geert GODERIS², Etienne DE CLERCQ³
1. Institut Scientifique de Santé Publique, Direction Opérationnelle, Santé Publique et Surveillance,
Service Etude des Soins de Santé
2. Katholieke Universiteit Leuven, Academisch Centrum Huisartsgeneeskunde
3. Université Catholique de Louvain, Institut de Recherche Santé et Société (IRSS)

© Institut scientifique de Santé publique, Bruxelles 2013
Ce rapport ne peut être reproduit, publié ou distribué sans l’accord écrit de l’ISP.
3
Le projet a été financé par l’Institut national d’assurance maladie-invalidité (INAMI).
Le projet a été réalisé en colloboration avec l’Institut de Recherche Santé et Société (IRSS) de
l’Université Catholique de Louvain en le Academisch Centrum Huisartsgeneeskunde van de
Katholieke Universiteit Leuven.
Contact
Dr Viviane Van Casteren
Institut Scientifique de la Santé Publique
Santé publique et Surveillance
Rue Juliette Wytsman 14
1050 Bruxelles
Belgique
viviane.vancasteren @wiv-isp.be
Comment faire référence à ce document ?
Viviane Van Casteren, Nathalie Bossuyt, Sarah Moreels, Katrien Vanthomme, Geert Goderis,
Etienne De Clercq. Trajets de soins diabète sucré de type 2 et insuffisance rénale chronique : impact sur
la qualité des soins, 2013. Bruxelles : Institut scientifique de la Santé publique (WIV-ISP). 2013.
Numéro de référence interne 2013-019. Numéro de dépôt ou ISSN : D/2013/2505/25.
Ce document est disponible sur le site Internet de l’Institut scientifique de Santé publique : www.wiv-
isp.be.
Remerciements
Les auteurs remercient tous les médecins qui ont collaboré à la communication des données.
Les auteurs remercient le Prof. Dr. Johan Wens (Université d’Anvers) pour son importante contribution à
la formulation des paramètres liés à la qualité des soins pour le trajet de soins diabète de type 2.
Un grand merci aux experts du Comité scientifique pour leur précieuse contribution à l’analyse et la
communication des résultats. Les membres du Comité scientifique sont (par ordre alphabétique) :
André Bodson Joëlle Nortier
Luk Buyse
Thomas Orban
Ann Ceuppens Jean-Michel Pochet
Kathleen Claes Michel Ponchon
Christophe De Block
Olga Van De Vloed
Pierre Drielsma Simon Van Hooland
Luc Herry
Gijs Van Pottelbergh
Georges Krzentowski Francis Verbeke
Chantal Mathieu Ann Verhaegen
Marie
-
Carmen Muniz
Johan Wens
Frank Nobels

4
.
Liste des abréviations
ACHIL Ambulatory Care Health Information Laboratory
ADO: antidiabétiques oraux
AIM: Agence InterMutualiste
AINS: anti-inflammatoires non stéroïdiens
ATC: classification anatomique, thérapeutique et chimique (avec dose quotidienne définie)
Ca: calcium
CIM-9/10: 9/10
ième
version de la Classification Internationale des Maladies
CISP-2: 2
ième
version de la Classification Internationale des Soins Primaires
CV: cardio-vasculaire
DDD: dose quotidienne définie (defined daily dose)
DM2: diabète sucré de type 2
DMG: dossier médical global
DMI: dossier médical informatisé
EPO: érythropoïétine
Hb: hémoglobine
HCO
3
: bicarbonate
HDL: lipoprotéines de haute densité
IC à 95%: intervalle de confiance à 95%
IC: intervalle de confiance
ICC: coefficient de corrélation intra-classe
IMC: indice de masse corporelle
INAMI Institut national d'assurance maladie-invalidité
IRC: insuffisance rénale chronique
KCE: Centre fédéral d’expertise des soins de santé
LDL: lipoprotéines de faible densité
MDRD: vitesse de filtration glomérulaire (modification of diet in renal diseases)
MOR: median odds ratio
MV: Médecins Vigies
N: nombre
OCDE: Organisation de Coopération et de Développement Economiques
OMS: Organisation mondiale de la Santé
P: phosphate
P25: premier quartile (limite supérieure de 25% des observations)
P50: deuxième quartile (médiane)
P75: troisième quartile (limite supérieure de 75% des observations)
PNB: produit national brut
PTH: parathormone
RML: réseau multidisciplinaire local
RSW: Réseau Santé Wallon
SRAA: Système rénine-angiotensine-aldostérone
TAd: tension artérielle diastolique
TAs: tension artérielle systolique
TS: trajet de soins
TTP: Trusted Third Party
WIV-ISP: Wetenschappelijk Instituut Volksgezondheid – Institut scientifique de Santé publique

5
Table des matières
1. Synthèse .............................................................................................................................................. 8
2. Introduction ....................................................................................................................................... 9
3. Méthodologie .................................................................................................................................... 11
3.1. Pilier central .............................................................................................................................. 12
3.2. Pilier AIM .................................................................................................................................. 13
3.3. Pilier Intego ............................................................................................................................... 14
3.4. Médecins Vigies ........................................................................................................................ 15
4. Trajet de soins diabète sucré de type 2 .......................................................................................... 18
4.1. Description des patients atteints d’un diabète sucré de type 2 .................................................. 18
4.1.1 Caractéristiques de base des patients atteints d’un diabète sucré de type 2 ...................... 18
4.1.2 Pratiques et RML ............................................................................................................... 27
4.2. Le contrat trajet de soins diabète sucré de type 2 ...................................................................... 28
4.2.1 Respect des conditions du contrat trajet de soins diabète .................................................. 28
4.2.2 Usage des mesures visant à faciliter l’autogestion du diabète ........................................... 28
4.2.3 Passage de la convention diabète vers le trajet de soins .................................................... 30
4.3. Trajet de soins diabète sucré de type 2 : découvertes principales ............................................. 30
4.3.1 Un nombre non négligeable de patients pour un trajet de soins avait probablement déjà été
repris au cours de la période 2009-2011 ............................................................................................ 30
4.3.2 Les patients en TS nécessitaient déjà une attention particulière au cours des années
précédant et autour du début du TS ................................................................................................... 31
4.3.3 Au cours des années ayant précédé le début du trajet de soins, de plus en plus de patients
en TS ont fait l'objet d'un suivi plus adéquat, tant dans le temps qu'en comparaison avec d'autres
patients diabétiques ........................................................................................................................... 34
4.3.4 Le début du trajet de soins génère un groupe additionnel de patients en TS bénéficiant
d'un suivi adéquat, tant en comparaison avec le passé qu’avec d’autres patients diabétiques. ......... 37
4.3.5 Les paramètres de résultat obligatoires indiquent que le lancement d’un TS s’accompagne
d’une évolution positive, mais les analyses actuelles ne permettent pas d'établir un lien de cause à
effet entre l'intégration dans un trajet de soins et l'amélioration ....................................................... 40
5. Trajet de soins Insuffisance rénale chronique .............................................................................. 42
5.1. Description des patients atteints d’insuffisance rénale chronique ............................................. 42
5.1.1 Caractéristiques de base des patients ................................................................................. 42
5.1.2 Pratiques et RML ............................................................................................................... 55
5.2. Le contrat trajet de soins insuffisance rénale chronique ............................................................ 56
5.2.1 Respect des conditions du contrat trajet de soins insuffisance rénale chronique .............. 56
5.2.2 Usage des mesures visant à faciliter l’autogestion du diabète ........................................... 57
5.3. Trajet de soins insuffisance rénale chronique : découvertes principales ................................... 59
5.3.1 Un nombre non négligeable de patients pour un trajet de soins avait probablement été
repris au cours de la période 2009-2011 ............................................................................................ 59
5.3.2 Avant le début du TS, les patients TS ont présenté une dégradation plus rapide de la
fonction rénale que les patients éligibles pour un TS mais pas inclus ............................................... 60
5.3.3 Avant le début du trajet de soins, de plus en plus de patients en TS ont fait l'objet d'un
suivi adéquat, tant dans le temps qu'en comparaison avec d'autres patients en insuffisance rénale
chronique62
5.3.4 Autour du début du TS, on observe un groupe additionnel de patients TS bénéficiant d'un
suivi adéquat, tant en comparaison avec le passé qu’avec d'autres patients en insuffisance rénale
chronique63
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
1
/
128
100%