Faut-il avancer l`âge du début du dépistage

COLLÈGE NATIONAL
DES GYNÉCOLOGUES ET OBSTÉTRICIENS FRANÇAIS
Président : Professeur B. Blanc
Extrait des
Mises à jour
en Gynécologie
Médicale
–
Volume 2003
publié le 27.11.2003
VINGT-SEPTIÈMES JOURNÉES NATIONALES
Paris, 2003

97
E
n
F
r
a
n
c
e
,
l
e
c
a
n
c
e
r
d
u
co
l
r
e
s
t
e
l
e
4
e
c
a
n
c
e
r
f
é
m
i
n
i
n
a
p
r
è
s
l
e
s
c
a
n
c
e
r
s
d
u
s
e
i
n
,
d
u
co
l
o
n
e
t
d
e
l
’
e
n
d
o
m
è
t
r
e
.
P
o
u
r
t
a
n
t
,
il
e
s
t
d
é
m
o
n
t
r
é
d
e
p
u
i
s
p
l
u
s
d
e
40
a
n
s
q
u
e
l
e
d
é
p
i
s
-
t
a
g
e
d
e
s
l
é
s
i
o
n
s
p
r
é
c
a
n
c
é
r
e
u
s
e
s
e
t
l
e
u
r
t
r
a
i
t
e
m
e
n
t
fo
n
t
l
a
p
r
é
-
v
e
n
t
i
o
n
d
u
c
a
n
c
e
r
i
n
v
a
s
i
f
d
u
co
l
.
S
o
n
i
n
c
i
d
e
n
c
e
e
s
t
d
e
10
p
o
u
r
100 000
e
t
il
r
e
s
t
e
r
e
s
p
o
n
s
a
b
l
e
d
e
1 600
d
é
c
è
s
p
a
r
a
n
.
O
n
e
s
t
e
n
co
r
e
l
o
i
n
d
u
r
e
co
r
d
d
e
l
a
F
i
n
l
a
n
d
e
o
ù
l
’
i
n
c
i
d
e
n
c
e
e
s
t
d
e
2,7
p
o
u
r
100 000.
C
o
mm
e
n
t
a
m
é
li
o
r
e
r
c
e
s
c
h
i
ff
r
e
s
?
–
S
a
n
s
nu
l
d
o
u
t
e
e
n
a
u
g
m
e
n
t
a
n
t
l
a
co
u
v
e
r
t
u
r
e
d
u
d
é
p
i
s
t
a
g
e
c
a
r
,
d
a
n
s
n
o
t
r
e
e
x
p
é
r
i
e
n
c
e
, 60
%
d
e
s
f
e
mm
e
s
q
u
i
p
r
é
s
e
n
t
e
n
t
un
c
a
n
c
e
r
i
n
v
a
s
i
f
d
u
co
l
n
’
o
n
t
j
a
m
a
i
s
e
u
d
e
f
r
o
tt
i
s
.
–
C
e
r
t
a
i
n
e
m
e
n
t
e
n
a
m
é
li
o
r
a
n
t
l
a
s
e
n
s
i
b
ili
t
é
d
u
d
é
p
i
s
t
a
g
e
c
a
r
,
d
a
n
s
l
e
s
s
é
r
i
e
s
l
e
s
p
l
u
s
r
é
c
e
n
t
e
s
,
l
e
p
o
u
r
c
e
n
t
a
g
e
d
e
c
a
n
c
e
r
s
s
u
r
v
e
n
a
n
t
c
h
e
z
l
e
s
f
e
mm
e
s
d
é
p
i
s
t
ée
s
a
u
g
m
e
n
t
e
s
e
n
s
i
b
l
e
m
e
n
t
.
–
P
e
u
t
-
ê
t
r
e
e
n
a
v
a
n
ç
a
n
t
l
’
â
g
e
d
u
d
é
p
i
s
t
a
g
e
?
C
’
e
s
t
à
c
e
tt
e
q
u
e
s
t
i
o
n
q
u
’
il
n
o
u
s
f
a
u
t
r
é
p
o
n
d
r
e
.
*
C
e
n
t
r
e
d
e
G
y
n
é
co
l
o
g
i
e
O
b
s
t
é
t
r
i
q
u
e
–
C
H
U
124
r
u
e
C
a
m
ill
e
D
e
s
m
o
u
li
n
s
– 80054
A
M
I
E
N
S
Faut-il avancer l'âge
du début du dépistage ?
M
.
-
H
.
H
É
R
A
U
D
,
M
.
-
F
.
É
T
I
E
NN
E
,
J
.
-
C
H
.
B
O
U
L
A
N
G
E
R
*
(A
m
i
e
n
s
)

HISTOIRE NATURELLE DU CANCER
L
e
c
a
n
c
e
r
d
u
co
l
n
e
n
a
î
t
p
a
s
s
u
r
un
co
l
s
a
i
n
.
L
a
n
o
t
i
o
n
d
e
l
é
s
i
o
n
s
p
r
é
c
a
n
c
é
r
e
u
s
e
s
a
v
a
i
t
é
t
é
s
u
s
p
e
c
t
ée
d
è
s
1908
p
a
r
S
c
h
a
u
e
n
s
t
e
i
n
e
t
R
u
b
i
n
.
–
P
o
u
r
c
e
r
t
a
i
n
s
,
l
’
é
v
o
l
u
t
i
o
n
n
a
t
u
r
e
ll
e
s
e
f
a
i
t
c
l
a
ss
i
q
u
e
m
e
n
t
e
n
p
a
ss
a
n
t
p
r
o
g
r
e
ss
i
v
e
m
e
n
t
d
e
C
I
N
1
à
C
I
N
2
p
u
i
s
à
C
I
N
3.
–
P
o
u
r
d
’
a
u
t
r
e
s
,
l
e
s
d
i
v
e
r
s
e
s
l
é
s
i
o
n
s
p
r
é
c
a
n
c
é
r
e
u
s
e
s
n
e
s
o
n
t
p
a
s
un
e
s
u
i
t
e
m
a
i
s
un
m
o
d
e
d
e
r
é
p
o
n
s
e
d
i
ff
é
r
e
n
t
à
un
m
ê
m
e
s
t
i
-
m
u
l
u
s
.
Q
u
o
i
q
u
’
il
e
n
s
o
i
t
,
o
n
e
s
t
i
m
e
q
u
’
il
e
x
i
s
t
e
un
i
n
t
e
r
v
a
ll
e
m
o
y
e
n
d
e
13
a
n
s
e
n
t
r
e
l
a
p
r
e
m
i
è
r
e
t
r
a
n
s
fo
r
m
a
t
i
o
n
c
e
ll
u
l
a
i
r
e
e
t
l
e
c
a
n
-
c
e
r
i
n
v
a
s
i
f
.
O
n
s
a
i
t
m
a
i
n
t
e
n
a
n
t
q
u
e
l
e
primum movens
d
e
c
e
tt
e
t
r
a
n
s
-
fo
r
m
a
t
i
o
n
c
e
ll
u
l
a
i
r
e
e
s
t
l
e
p
a
p
ill
o
m
a
v
i
r
u
s
hu
m
a
i
n
(
H
P
V)
.
I
l
e
s
t
a
d
m
i
s
q
u
e
H
P
V
e
s
t
l
a
co
n
d
i
t
i
o
n
n
é
c
e
ss
a
i
r
e
m
a
i
s
n
o
n
s
u
ff
i
s
a
n
t
e
d
u
c
a
n
c
e
r
d
u
co
l
e
t
q
u
e
l
e
c
a
n
c
e
r
d
u
co
l
e
s
t
l
e
p
r
e
m
i
e
r
e
x
e
m
p
l
e
d
e
t
u
m
e
u
r
s
o
li
d
e
v
i
r
o-
i
n
d
u
i
t
e
.
L
a
co
n
f
é
r
e
n
c
e
d
e
co
n
s
e
n
s
u
s
d
e
L
ill
e
e
n
1990
a
v
a
i
t
e
s
t
i
m
é
q
u
’
il
f
a
ll
a
i
t
co
mm
e
n
c
e
r
l
e
d
é
p
i
s
t
a
g
e
à
25
a
n
s
.
L
e
s
r
e
co
mm
a
n
d
a
-
t
i
o
n
s
d
e
l
’
A
N
A
E
S
e
n
1994
a
v
a
i
e
n
t
a
b
a
i
ss
é
l
’
â
g
e
d
u
d
é
b
u
t
d
u
d
é
p
i
s
t
a
g
e
à
20
a
n
s
.
C
e
r
t
a
i
n
s
p
e
n
s
e
n
t
q
u
’
il
f
a
u
d
r
a
i
t
co
mm
e
n
c
e
r
d
è
s
l
e
d
é
b
u
t
d
e
l
’
a
c
t
i
v
i
t
é
s
e
x
u
e
ll
e
.
FAUT-IL AVANCER L’ÂGE DU DÉPISTAGE ?
Il existe un certain nombre d’éléments en faveur.
1. Le comportement sexuel des moins de 20 ans
B
e
a
u
co
u
p
i
n
s
i
s
t
e
n
t
s
u
r
l
e
r
a
j
e
un
i
ss
e
m
e
n
t
d
e
s
p
r
e
m
i
e
r
s
r
a
p
-
p
o
r
t
s
s
e
x
u
e
l
s
e
t
l
e
s
co
m
p
o
r
t
e
m
e
n
t
s
à
r
i
s
q
u
e
d
e
co
n
t
a
m
i
n
a
t
i
o
n
p
a
r
un
e
M
S
T
c
h
e
z
l
e
s
a
d
o
l
e
s
c
e
n
t
s
.
U
n
e
e
n
q
u
ê
t
e
m
e
n
ée
p
a
r
l
’
I
N
S
E
R
M
e
n
1994
r
a
pp
o
r
t
a
i
t
q
u
e
13
%
d
e
s
f
ill
e
s
d
e
14
-
15
a
n
s
a
v
a
i
e
n
t
d
é
j
à
e
u
d
e
s
r
a
pp
o
r
t
s
s
e
x
u
e
l
s
(
1
)
.
E
n
1998, 45,8
%
d
e
s
a
d
o
l
e
s
c
e
n
t
e
s
d
e
15
à
19
a
n
s
d
i
s
e
n
t
a
v
o
i
r
un
e
a
c
t
i
v
i
t
é
s
e
x
u
e
ll
e
r
é
g
u
li
è
r
e
.
U
n
e
e
n
q
u
ê
t
e
s
u
r
l
e
s
j
e
un
e
s
d
e
15
à
18
a
n
s
,
r
é
a
li
s
ée
e
n
1994
p
a
r
l
’
A
N
R
S
(A
g
e
n
c
e
N
a
t
i
o
n
a
l
e
d
e
R
e
c
h
e
r
c
h
e
s
u
r
l
e
S
I
D
A)
,
98
HÉRAUD & COLL.

m
o
n
t
r
e
q
u
e
l
’
u
s
a
g
e
d
u
p
r
é
s
e
r
v
a
t
i
f
n
e
s
’
i
n
s
c
r
i
t
p
a
s
d
a
n
s
l
a
d
u
r
ée
:
l
e
p
o
u
r
c
e
n
t
a
g
e
d
’
u
t
ili
s
a
t
e
u
r
s
co
mm
e
n
c
e
à
b
a
i
ss
e
r
n
e
tt
e
m
e
n
t
l
o
r
s
q
u
e
l
a
r
e
l
a
t
i
o
n
e
n
t
r
e
p
a
r
t
e
n
a
i
r
e
s
d
é
p
a
ss
e
3
o
u
4
m
o
i
s
.
L
e
s
j
e
un
e
s
m
u
l
t
i
p
a
r
t
e
n
a
i
r
e
s
n
’
a
y
a
n
t
p
a
s
u
t
ili
s
é
d
e
p
r
é
s
e
r
v
a
t
i
f
l
o
r
s
d
u
d
e
r
n
i
e
r
r
a
pp
o
r
t
,
a
l
o
r
s
q
u
e
c
e
l
u
i
-c
i
é
t
a
i
t
à
r
i
s
q
u
e
d
e
t
r
a
n
s
m
i
ss
i
o
n
d
e
M
S
T
,
r
e
p
r
é
s
e
n
t
e
n
t
10
%
d
e
s
15
à
18
a
n
s
(
s
o
u
r
c
e
:
O
R
S
I
l
e
-
d
e
-
F
r
a
n
c
e
)
(
2
)
.
A
i
n
s
i
,
il
e
x
i
s
t
e
b
i
e
n
c
h
e
z
l
e
s
m
o
i
n
s
d
e
20
a
n
s
un
r
i
s
q
u
e
d
e
M
S
T
t
e
ll
e
s
q
u
e
l
e
s
i
n
f
e
c
t
i
o
n
s
à
p
a
p
ill
o
m
a
v
i
r
u
s
hu
m
a
i
n
,
p
o
u
v
a
n
t
ê
t
r
e
à
l
’
o
r
i
g
i
n
e
d
e
l
é
s
i
o
n
s
p
r
é
c
a
n
c
é
r
e
u
s
e
s
.
2. Prévalence et incidence des lésions virales
M
o
n
t
e
z
m
è
n
e
e
n
1999
a
u
x
É
t
a
t
s
-
U
n
i
s
un
e
é
t
u
d
e
s
u
r
10 296
p
a
t
i
e
n
t
e
s
â
g
ée
s
d
e
10
à
19
a
n
s
e
t
69 684
â
g
ée
s
d
e
p
l
u
s
d
e
20
a
n
s
.
I
l
m
o
n
t
r
e
q
u
e
l
a
p
r
é
v
a
l
e
n
c
e
d
e
l
’
i
n
f
e
c
t
i
o
n
p
a
r
l
’
H
P
V
e
s
t
p
l
u
s
i
m
p
o
r
-
t
a
n
t
e
c
h
e
z
l
e
s
m
o
i
n
s
d
e
20
a
n
s
:
14,6
%
o
n
t
un
f
r
o
tt
i
s
p
o
s
i
t
i
f
à
H
P
V
p
o
u
r
9,7
%
d
e
s
p
l
u
s
d
e
20
a
n
s
(
3
)
.
C
e
n
’
e
s
t
p
a
s
n
o
t
r
e
e
x
p
é
r
i
e
n
c
e
p
u
i
s
q
u
e
d
a
n
s
n
o
t
r
e
é
t
u
d
e
e
ll
e
e
s
t
m
a
x
i
m
u
m
e
n
t
r
e
25
e
t
29
a
n
s
.
D
’
a
u
t
r
e
s
é
t
u
d
e
s
c
h
e
r
c
h
e
n
t
à
é
v
a
l
u
e
r
l
’
i
m
p
o
r
t
a
n
c
e
d
e
l
’
i
n
c
i
-
d
e
n
c
e
d
e
l
’
H
P
V
c
h
e
z
l
e
s
m
o
i
n
s
d
e
20
a
n
s
:
W
oo
d
m
a
n
s
u
i
t
1 075
j
e
un
e
s
f
ill
e
s
â
g
ée
s
d
e
15
à
19
a
n
s
,
r
é
c
e
m
-
m
e
n
t
a
c
t
i
v
e
s
s
e
x
u
e
ll
e
m
e
n
t
,
e
t
c
h
e
z
l
e
s
q
u
e
ll
e
s
l
a
c
y
t
o
l
o
g
i
e
e
s
t
n
o
r
m
a
l
e
e
t
l
’
H
P
V
n
é
g
a
t
i
f
a
u
d
é
b
u
t
d
e
l
’
é
t
u
d
e
.
I
l
co
n
c
l
u
t
q
u
e
l
e
r
i
s
q
u
e
c
u
m
u
l
a
t
i
f
à
3
a
n
s
d
e
v
o
i
r
s
u
r
v
e
n
i
r
un
e
i
n
f
e
c
t
i
o
n
à
H
P
V
e
s
t
d
e
44
%
(
4
)
.
G
l
o
r
i
a
s
u
i
t
608
é
t
u
d
i
a
n
t
e
s
t
o
u
s
l
e
s
s
i
x
m
o
i
s
p
e
n
d
a
n
t
t
r
o
i
s
a
n
s
e
t
r
é
a
li
s
e
un
e
P
CR
à
l
a
r
e
c
h
e
r
c
h
e
d
’
H
P
V
.
L
e
s
r
é
s
u
l
t
a
t
s
s
o
n
t
s
i
m
il
a
i
r
e
s
:
l
’
i
n
c
i
d
e
n
c
e
c
u
m
u
l
a
t
i
v
e
s
u
r
36
m
o
i
s
d
’
i
n
f
e
c
t
i
o
n
p
a
r
H
P
V
e
s
t
d
e
43
%
(
95
%
I
C
:
36
à
49
%)
(
5
)
.
C
e
co
n
s
t
a
t
e
s
t
a
pp
u
y
é
p
a
r
l
e
s
r
é
s
u
l
t
a
t
s
d
’
un
e
é
t
u
d
e
r
é
a
li
s
ée
e
n
1994
p
a
r
l
a
F
CR
I
S
A
P
(
F
é
d
é
r
a
t
i
o
n
d
e
s
C
e
n
t
r
e
s
d
e
R
e
g
r
o
u
-
p
e
m
e
n
t
I
n
fo
r
m
a
t
i
q
u
e
e
t
S
t
a
t
i
s
t
i
q
u
e
e
n
A
n
a
t
o
m
i
e
e
t
C
y
t
o
l
o
g
i
e
P
a
t
h
o
l
o
g
i
q
u
e
s
)
q
u
i
a
a
n
a
l
y
s
é
815 842
F
C
V
p
r
é
l
e
v
é
s
e
n
F
r
a
n
c
e
e
n
1992.
E
ll
e
m
o
n
t
r
e
q
u
e
2,19
%
d
e
s
p
a
t
i
e
n
t
e
s
â
g
ée
s
d
e
15
à
19
a
n
s
s
o
n
t
p
o
r
t
e
u
s
e
s
d
e
co
n
d
y
l
o
m
e
s
p
o
u
r
2,56
%
d
e
s
20
-
24
a
n
s
, 2,26
%
d
e
s
25
-
29
a
n
s
e
t
1,93
%
d
e
s
30
-
34
a
n
s
(
6
)
.
3. La fréquence des lésions précancéreuses
D
a
n
s
c
e
tt
e
m
ê
m
e
é
t
u
d
e
,
l
a
f
r
é
q
u
e
n
c
e
d
e
s
n
é
o
p
l
a
s
i
e
s
i
n
t
r
a
-
é
p
i
t
h
é
li
a
l
e
s
,
t
o
u
s
g
r
a
d
e
s
co
n
fo
n
d
u
s
,
e
s
t
d
e
0,13
%
c
h
e
z
l
e
s
15
-
19
a
n
s
p
o
u
r
0,23
%
d
e
s
20
-
24
a
n
s
, 0,43
%
d
e
s
25
-
29
a
n
s
e
t
0,52
%
d
e
s
30
-
34
a
n
s
(
s
o
u
r
c
e
F
CR
I
S
A
P
)
(
6
)
.
99
FAUT-IL AVANCER L'ÂGE DU DÉBUT DU DÉPISTAGE ?

M
a
i
s
il
e
x
i
s
t
e
d
’
a
u
t
r
e
s
é
t
u
d
e
s
co
m
p
a
r
a
n
t
l
e
p
o
u
r
c
e
n
t
a
g
e
d
’
a
n
o
m
a
li
e
s
c
y
t
o
l
o
g
i
q
u
e
s
o
u
h
i
s
t
o
l
o
g
i
q
u
e
s
c
h
e
z
l
e
s
a
d
o
l
e
s
c
e
n
t
e
s
e
t
l
e
s
a
d
u
l
t
e
s
, q
u
i
m
o
n
t
r
e
n
t
q
u
e
c
e
ll
e
s
-c
i
s
o
n
t
p
l
u
s
f
r
é
q
u
e
n
t
e
s
c
h
e
z
l
e
s
m
o
i
n
s
d
e
20
a
n
s
:
Si
m
i
r
é
t
u
d
i
e
e
n
1997 524
F
C
V
r
é
a
li
s
é
s
c
h
e
z
d
e
s
a
d
o
l
e
s
c
e
n
t
e
s
e
t
co
n
s
t
a
t
e
q
u
e
29
%
d
’
e
n
t
r
e
e
ll
e
s
o
n
t
d
e
s
f
r
o
tt
i
s
a
n
o
r
m
a
u
x
,
t
o
u
t
e
s
a
n
o
m
a
li
e
s
co
n
fo
n
d
u
e
s
,
co
n
t
r
e
23
%
c
h
e
z
l
e
s
a
d
u
l
t
e
s
(
7
)
.
Sil
v
a
é
t
u
d
i
e
a
u
B
r
é
s
il
,
e
n
t
r
e
1987
e
t
1999, 110 283
F
C
V
d
o
n
t
11 966
c
h
e
z
d
e
s
f
e
mm
e
s
â
g
ée
s
d
e
m
o
i
n
s
d
e
20
a
n
s
e
t
98 317
c
h
e
z
d
e
s
f
e
mm
e
s
d
e
p
l
u
s
d
e
20
a
n
s
.
L
e
s
C
I
N
1
é
t
a
i
e
n
t
b
e
a
u
co
u
p
p
l
u
s
f
r
é
q
u
e
n
t
s
d
a
n
s
l
e
p
r
e
m
i
e
r
g
r
o
u
p
e
q
u
e
l
e
s
e
co
n
d
:
1,73
%
co
n
t
r
e
0,99
%
(
8
)
.
E
n
1997,
H
u
r
l
e
y
a
n
a
l
y
s
e
897 900
p
r
é
l
è
v
e
m
e
n
t
s
d
u
s
e
r
v
i
c
e
d
e
c
y
t
o
p
a
t
h
o
l
o
g
i
e
d
e
l
’
un
i
v
e
r
s
i
t
é
d
u
M
i
ss
i
ss
i
p
i
,
r
é
p
a
r
t
i
s
e
n
3
g
r
o
u
p
e
s
:
12
-
17
a
n
s
, 18
-
34
a
n
s
,
e
t
p
l
u
s
d
e
35
a
n
s
.
L
e
s
p
r
é
l
è
v
e
-
m
e
n
t
s
o
n
t
é
t
é
c
l
a
ss
é
s
e
n
:
n
é
g
a
t
i
f
,
i
n
s
a
t
i
s
f
a
i
s
a
n
t
,
a
t
y
p
i
e
,
C
I
N
1,
C
I
N
2,
C
I
N
3
e
t
c
a
r
c
i
n
o
m
e
i
n
v
a
s
i
f
.
L
e
s
r
é
s
u
l
t
a
t
s
d
e
c
e
tt
e
é
t
u
d
e
m
o
n
t
r
e
n
t
q
u
e
d
e
s
l
é
s
i
o
n
s
c
e
r
v
i
c
a
l
e
s
s
o
n
t
s
i
g
n
i
f
i
c
a
t
i
v
e
m
e
n
t
p
l
u
s
n
o
m
b
r
e
u
s
e
s
p
a
r
m
i
l
e
s
j
e
un
e
s
a
d
u
l
t
e
s
(
9
)
.
D
a
n
s
s
o
n
é
t
u
d
e
,
M
o
n
t
e
z
t
r
o
u
v
e
q
u
e
3,77
%
d
e
s
a
d
o
l
e
s
c
e
n
t
e
s
o
n
t
d
e
s
l
é
s
i
o
n
s
i
n
t
r
a
-
é
p
i
t
h
é
li
a
l
e
s
co
n
t
r
e
2,13
%
d
e
s
a
d
u
l
t
e
s
(
4
)
.
U
n
e
a
u
t
r
e
é
t
u
d
e
,
c
e
ll
e
d
e
U
t
a
g
a
w
a
,
m
e
n
ée
a
u
B
r
é
s
il
d
e
1987
à
1995,
s
’
i
n
t
é
r
e
ss
e
à
l
’
é
v
o
l
u
t
i
o
n
d
e
l
a
f
r
é
q
u
e
n
c
e
d
e
s
F
C
V
a
n
o
r
-
m
a
u
x
d
e
s
m
o
i
n
s
d
e
21
a
n
s
d
u
r
a
n
t
c
e
s
8
a
nn
ée
s
.
E
ll
e
a
é
t
é
m
u
l
-
t
i
p
li
ée
p
a
r
4,
p
a
ss
a
n
t
d
e
0,64
%
à
2,10
%
(
10
)
.
4. Enfin, la littérature rapporte même l’existence de cas
de cancers invasifs du col avant 20 ans.
M
a
i
m
a
n
,
e
n
1990,
c
i
t
e
d
a
n
s
un
e
é
t
u
d
e
s
’
i
n
t
é
r
e
ss
a
n
t
à
l
’
a
ss
o-
c
i
a
t
i
o
n
S
I
D
A-
n
é
o
p
l
a
s
i
e
d
u
co
l
,
l
e
c
a
s
d
’
un
e
a
d
o
l
e
s
c
e
n
t
e
d
e
16
a
n
s
a
tt
e
i
n
t
e
d
’
un
c
a
n
c
e
r
i
n
v
a
s
i
f
s
t
a
d
e
3
B
(
11
)
.
A
i
n
s
i
d
e
n
o
m
b
r
e
u
x
a
u
t
e
u
r
s
p
r
é
co
n
i
s
e
n
t
d
e
d
é
b
u
t
e
r
l
e
s
f
r
o
t
-
t
i
s
d
è
s
l
e
s
p
r
e
m
i
e
r
s
r
a
pp
o
r
t
s
s
e
x
u
e
l
s
.
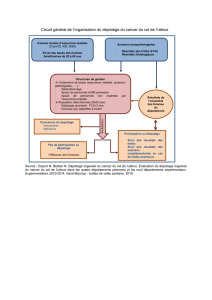
Pourtant de nombreux arguments sont contre :
1. L’évolution de l’infection à HPV, se fait le plus souvent
vers l’élimination spontanée.
D
a
n
s
s
o
n
é
t
u
d
e
,
G
l
o
r
i
a
s
u
i
t
608
é
t
u
d
i
a
n
t
e
s
t
o
u
s
l
e
s
s
i
x
m
o
i
s
p
e
n
d
a
n
t
t
r
o
i
s
a
n
s
.
I
l
r
é
a
li
s
e
un
e
P
CR
à
l
a
r
e
c
h
e
r
c
h
e
d
’
H
P
V
.
I
l
m
o
n
t
r
e
q
u
e
l
a
d
u
r
ée
m
é
d
i
a
n
e
d
e
s
n
o
u
v
e
ll
e
s
i
n
f
e
c
t
i
o
n
s
e
s
t
d
e
8
100
HÉRAUD & COLL.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%