Unité B: Composition et modification chimique

Unité B: Composition et modification chimique: Thème 1
Système d’information sur les matières dangereuses utilisées au travail
(SIMDUT) :
Matière
Substances pures Mélanges
Éléments Composés Solutions Mécaniques Suspensions Colloïdes
Classification
Exemple
Substance pure : Formée d'un seul type de particules. Elle a des
caractéristiques chimiques et physiques uniques.
1. Élément: une substance qui ne peut pas être réduit en substances plus
simples.
2. Composé: quand deux ou plus éléments sont combinés ensemble.
Mélange : Une combinaison de substances pures où les propriétés
peuvent varier dépendant sur les quantités de chaque substance.
1. Mélange homogène (solution): Distribution uniforme des particules.
Habituellement limpide à l'état liquide et il est impossible de séparer les
différentes particules par simple filtration.
2. Mélange hétérogène (mélange mécanique): Distribution non
uniforme. On peut voir les différents types de particules à l'œil nu et le tout
reste mélangé.
Thème 2
Propriétés Chimiques:__________________________________________________________________________
_____________________________________________________________________________________________
Propriétés Physiques: __________________________________________________________________________
_____________________________________________________________________________________________
Propriétés chimiques
Propriétés physiques
Donnez un exemple de
produit qui utilise chaque
symbole illustrée à la
gauche.

Qualitative
Quantitative
Exemple : Donnez les propriétés de la poudre de Jello rouge. Identifiez-les comme chimique ou physique.
Changement Physique : la forme d’une substance est changé, mais non sa composition chimique. Le changement
est temporaire/réversible. Exemples : _____________________________________________________________
Changement chimique: cause la formation d'un ou de plusieurs substances avec des nouvelles propriétés qui est
difficile ou impossible à renverser. Ex: ____________________________________________________________
L’évidence pour les changements chimiques : Utilisez la page 102 pour faire une liste de l’évidence d’un
changement chimique.

Thème 3
Comment sont formés les éléments?
La loi des proportions définies (p. 107) : ___________________________________________________________
_____________________________________________________________________________________________
Comment est-ce qu’on a découvert au sujet des éléments? En décomposant!
La loi de la conservation de la masse (p. 107) : _____________________________________________________
_____________________________________________________________________________________________
Réactifs : ______________________________________________________________________________
Produits : ______________________________________________________________________________
Les Théories Atomiques
La Méthode Scientifique:
Observations Hypothèse Expériences Théorie Temps et autres expériences Théorie Révisé
Réviser l’hypothèse
Plusieurs fois comme nécessaire.
Loi: Décrire et donner un sommaire de ce qui se passe dans un système naturel.
Théories: Façons imaginatives à expliquer pourquoi quelque chose se passe dans un système naturel
Modèles: Aide à nous imaginer les structures ou les processus qui ne peuvent pas être vu directement.
Observations: De nombreuse observation doivent être faits avant que les communautés scientifiques accepteront les
théories.
Histoire des modèles atomiques:
Le modèle particulaire de la matière n’était pas suffisant pour expliquer la combinaison et la décomposition de
particules de substances distinctes. Il fallait donc trouver un autre modèle!
Théorie moderne:
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
La structure atomique:
PROTONS :
NEUTRONS :
ÉLECTRONS
Thème 4 – La Classification des éléments et Thème 5 – Le Tableau Périodique

Les symboles chimiques (p. 116) : Pour simplifier l’écriture des éléments
Exemples : Lithium = ________, Bore = _________; Magnésium = __________
Propriétés des métaux, non-métaux et métalloïdes: ils sont divisés par l’escalier sur le tableau périodique
État au
température de la
salle
Apparence
Conductivité (capable
de transférer l'énergie
électrique et
thermique)
Malléabilité (capable de
mouler la forme) et
ductilité (capable
d'étirer)
Métaux (gauche)
Non-métaux
(droite)
NB : H est un
non-métal!!!
Métalloïdes
(touchent
l’escalier)
L’origine du tableau périodique : Le tableau périodique a été développé par Dmitri Mendeleïev pour expliquer les
relations et les suites logiques parmi les éléments et leurs propriétés. Il a noté qu'il y aura des nouveaux éléments
découverts et il a laissé de l'espace dans son tableau. Dans l'espace de 16 ans, les trouées étaient remplies avec les
éléments qui allaient bien dans les suites logiques que Mendeleïev a prévus.
Sommaire du tableau périodique: Éléments 1 à 36 seulement
Familles 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
1
1
2
2
3
4
5
6
7
8
9
10
3
11
12
13
14
15
16
17
18
4
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
Périodes
Les rangés ou les périodes: Ils indiquent combien de niveaux d'électrons, couches ou orbitales électroniques
existent dans un élément spécifique. ILS SONT HORIZONTALES.
Les premiers deux éléments (hydrogène et hélium) tiennent un maximum de deux électrons dans le premier
orbital électronique.
Pour les éléments 3 à 18 (lithium à argon), les électrons remplis le premier orbitale électronique avec deux
électrons restants dans les orbitales progressives, chacun tenant un maximum de 8 électrons.
La rangée ou le période où se trouve un élément nous indique combien de couches électroniques existent dans
cet élément (Ex: Hydrogène est dans la première période et comprend une couche d'électrons. Azote est dans la
deuxième période et se comprend de deux couches d'électrons. )
Groupes ou familles : les éléments dans les mêmes groupes ou familles partagent les mêmes propriétés (Ex: les gaz
nobles sont tous dans le groupe 18). ILS SONT VERTICALES.
Les métaux alcalins :
Les métaux alcalinoterreux :
Les métaux de transitions :
Les Halogènes :
Les Gaz Nobles :

Composé Ionique : _____________________________________________________________
______________________________________________________________________________
Composé Moléculaire : _________________________________________________________
______________________________________________________________________________
Ionique
Moléculaire
Formé des éléments métalliques et
non métalliques
Forme des ions en solution
Conduit l'électricité
Solide à température ambiante
Forme cristalline distincte
Point de fondre très élevé
Liens créés par le transfert des
électrons
Composés moléculaires diatomiques: Les molécules qui ont deux atomes du même élément.
Ex: iode (I2), hydrogène (H2), azote (N2) brome (Br2) oxygène (O2), chlore (Cl2), et fluore (F2)
Il existe des autres composés moléculaires formés de plusieurs copies d’un seul élément :
Ex : soufre (S8), Phosphore (P4)
Les Formules Chimiques : utilise des symboles et des chiffres
On indique l’état de la matière en indice entre parenthèse après la formule chimique : solide (s), liquide (l), gaz (g)
ou aqueux (aq) si on parle d’un solide dissous dans l’eau.
Les symboles représentent les ______________________.
Les chiffres représentent les _______________________.
Combien d’atomes et d’éléments y a-t-il dans chaque exemple? Quel est l’état?
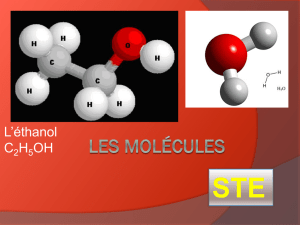
Ex. NaCl (s) (sel) C6H12O6 (s) (glucose) C12H22O11 (s) (sucrose)
 6
6
 7
7
 8
8
 9
9
1
/
9
100%