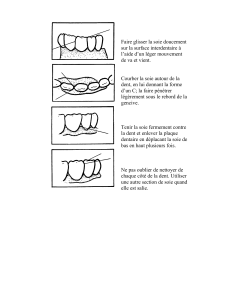
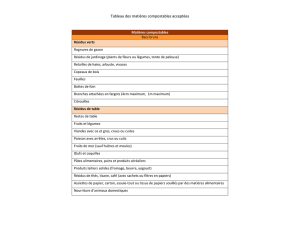
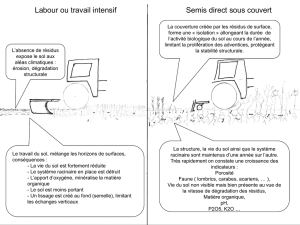
Protéines fibreuses

Protéines fibreuses
Fibroïne de la soie
La fibroïne existe dans la soie des toiles d'araignées (Web!) et dans le fil des vers à soie
(Bombyx). Elle existe sous forme de deux sous-unités (350-415 kD et 25 kD) liées par pont
bisulfure. Elles se trouvent initialement sous forme dissociée non polymérisée en solution
aqueuse très concentrée dans l'animal. Elle ne forme de filament qu'une fois dégurgitée à l'air.
La structure filamenteuse comprend des parties en feuillet parsemées de régions de structure
irrégulières mal connues. Les séquences en feuillet sont composées de répétitions d'environ
50 motifs du type (GA)2GSGAAG(SGAGAG)8Y. Dans la partie SGAGAG, les protons de G
se trouvent tous sur une même face, qui est donc très peu encombrée. L'empilement des
feuillets par ces faces est donc particulièrement facile. Les faces contenant la chaîne latérale
de S et A se rassemblent également. Cette structure explique le compactage de la fibroïne
mais aussi sa souplesse car il n'existe pas de liaison covalente entre les différentes parties.
Superenroulement
Dans beaucoup de protéines, on trouve un superenroulement d'hélice sous forme de torsade
gauche de deux ou trois hélices . Ces dernières, faiblement modifiées par rapport à la
structure classique, interagissent les unes avec les autres par des résidus hydrophobes d'une
part, et des résidus de charges complémentaires d'autre part, disposés de façon régulière. La
structure de ces protéines est facile à reconnaître à la lecture de la séquence primaire seule, car
elle présente de très longues répétitions de 7 acides aminés (heptades), abcdefg dans
lesquelles a et d sont hydrophobes, e et g permettent majoritairement les interactions
électrostatiques. On trouve en a surtout A, L et I. On trouve en d surtout A et L. En e se trouve
E et Q avec en face en g essentiellement K ou R. Enfin des résidus chargés sont très souvent
observés dans les autres positions (b,c et f) où ils interagissent avec le solvant. Une exception
dans le schéma de l'heptade se voit pour les résidus Pro qui sont quasiment absents.
Les torsades de deux hélices sont composées des deux chaînes de même taille, parfaitement
alignées (sans décalage de l'une avec l'autre) et parallèles. Elles peuvent être identiques ou
différentes. Il existe peu de torsade à trois brins (protéines extracellulaires, avec des brins
identiques ou différents). Il existe enfin des torsades à quatre brins, comme dans la soie des
abeilles, des guêpes et des fourmis.
La stabilité individuelle de chaque hélice est relativement faible. La formation en torsade
conduit au contraire à des câbles extrêmement solides. Bien souvent les parties filamenteuses
ne constituent pas la totalité de la structure et une tête globulaire apparaît, comme dans la
myosine par exemple. Ces structures torsadées participent très souvent à des complexes supra-
moléculaires dont l'arrangement varie rapidement en fonction de contraintes ou de signaux.
1
/
1
100%