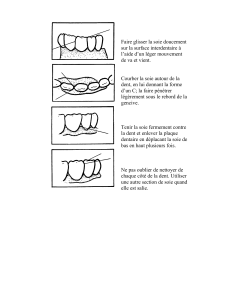
Aucun titre de diapositive

2
Structure des protéines – acides aminés
●Les protéines sont des polymères d’acides aminés
●La nature du groupe R sur la chaîne latérale marque la différence entre les
acides aminés
●Apolaires, aromatiques, polaires, chargés (+) ou (-)
NH3+CCOO-
R
H
R

3
Structure des protéines – acides aminés
●20 acides aminés naturels:
APOLAIRES ET ALIPHATIQUES
AROMATIQUES
POLAIRES NON CHARGÉS CHARGÉS POSITIVEMENT
CHARGÉS NÉGATIVEMENT
http://trc.ucdavis.edu/biosci10v/bis10v/week2/2webimages/ch5-amino-acids.jpg

4
Acides aminés
●Nomenclature
Alanine Ala A
Arginine Arg R
Asparagine Asn N
Aspartate Asp D
Cystéine Cys C
Glutamine Gln Q
Glutamate Glu E
Glycine Gly G
Histidine His H
Isoleucine Ile I
Leucine Leu L
Lysine Lys K
Méthionine Met M
Phénylalanine Phe F
Proline Pro P
Sérine Ser S
Thréonine Thr T
Tryptophane Trp W
Tyrosine Tyr Y
Valine Val V

5
Structure des protéines
●Les protéines sont composées d’acides aminés reliés entre eux dans une
séquence donnée par des liaisons amides aussi appelées liens peptidiques
●Voici la nomenclature des protéines:
●Les chaînes peptidiques ont un sens, donc deux extrémités différentes:
●N-terminale avec groupe ammonium libre
●C-terminale avec groupe carboxyle du dernier acide aminé
●On donne la séquence d’une protéine en commençant par le C-terminal
Koolman & Röhm (2004)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%