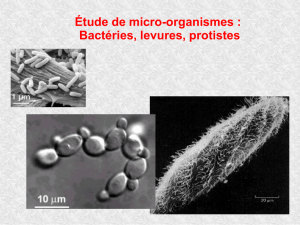
1 tout ce monde si petit, petit, petit, petit….

OS 5ème Planta/11-12
1
OS TRAVAUX PRATIQUES

OS 5ème Planta/11-12
2
1.1 Objectifs
Via des observations au microscope (frottis, eau ,étang) classer les êtres vivants
observés. Via une connexion Internet établir quelques caractéristiques des mêmes
échantillons.
1.2 Matériel et méthode
1. lames
2. microscope
3. ordinateurs
4. feuille et crayon
1.3 Déroulement de la manipulation
Pour chaque élève étudier un représentant :
5. des Protozoaires
6. des Algues
7. des Bactéries
8. des Champignons
A l’aide de votre cours, de la documentation et d’Internet établissez pour chaque être
vivant observé un tableau avec :
1. un dessin avec son nom
2. sa classification
3. ses principales caractéristiques (physiologiques, mode de reproduction, mode de
nourriture, mode de déplacement,caractéristiques spéciales, etc.).
Pour certains microorganismes pathogènes donnez les signes de la maladie
provoquée,le mode de transmission, les traitements.Pour les Bactéries précisez la
coloration de Gram ainsi que la forme.
Mise en commun des résultats.
1 TOUT CE MONDE SI PETIT, PETIT, PETIT, PETIT….

OS 5ème Planta/11-12
3
2.1 But
étude des relations génotype-phénotype.
utilisation de mutants themosensibles pour montrer que l’expression de certains
gènes dépend aussi de l’environnement (ici la température).
étude des relations structure-fonction.
2.2 Matériel et méthode
Souches de levure
[C] Schizosaccharomyces pombe
Cette souche présente la particularité de se reproduire par scissiparité (cloisonnement
transversal)
[Cdc] Schizosaccharomyces pombe cdc2-33
Souche mutée sur un gène impliqué dans la division cellulaire (le gène cdc2). Cette
mutation ne s’exprime qu’à partir d’une température donnée (thermosensible) ce qui
permet de mettre en évidence que l’expression de certains gènes dépend aussi de
l’environnement.
Cette mutation allonge le cycle cellulaire et se traduit par une taille des cellules plus
longue que la normale et des formes souvent aberrantes.
Milieux
A lire avant toute manipulation
Lorsque l’on manipule des micro-organismes, il faut prendre des précautions qui sont de
deux ordres : ne pas contaminer l’espèce étudiée avec des souches externes et ne pas
polluer l’environnement avec nos expériences. Ainsi, il est fondamental de respecter
certaines conditions expérimentales propres à l’espèce étudiée.
Voici quelques règles concernant la manipulation des levures :
nettoyage de la paillasse à l’alcool ou à l’eau de javel
travail dans un rayon de 30 cm autour de la flamme d’un bec bunsen
mains passées à l’alcool, port d’une blouse en coton
instruments et milieux stérilisés ouverts et utilisés autour de la flamme
ne mettre en contact que des matériels stérilisés entre eux et avec les cellules ; ne
pas poser le matériel sur la paillasse ni toucher le col des tubes ou la partie du
matériel qui sera en contact avec les levures, les milieux ou les solutions
pot avec javel pour récupérer les pipettes usagées
éviter lhes mouvements brusques, ne pas parler devant des boîtes ouvertes
2 INFLUENCE DE LA TEMPERATURE SUR LES GENES

OS 5ème Planta/11-12
4
les levures sédimentent rapidement, il est donc nécessaire d’agiter les suspensions
avant chaque prélèvement
noter au marqueur indélébile au dos des boîtes : initiales des binômes et
dénomination de la boîte.
2.3 Déroulement de la manipulation
2.3.1 Milieu pré stérilisé à couler :
Faire chauffer les bouteilles de milieu au bain-marie bouillant (niveau de l’eau : 1cm au
dessus du niveau du milieu) jusqu’à totale dissolution (30 à 60 minutes). Penser à
dévisser légèrement le bouchon pour éviter l’explosion. Laisser légèrement refroidir, puis
couler 16 à 17 boîtes par bouteille.
Soit faire fondre le milieu au micro-ondes, cependant éviter la puissance maximale et
surveiller pour éviter les projections (baisser alors la puissance) ; contrôler également
l’état du milieu toutes les 30 secondes (agiter par rotation) et penser à dévisser le
bouchon. Couler.
2.3.2 Repiquage des souches :
Donner à tous les binômes deux boîtes de pétri divisées en trois parties égales.
Au marqueur, diviser les boîtes (écrire au dos de la boîte).
Attribuer à chaque quartier une lettre correspondant au nom des souches.
Pour chaque souche : avec un ensemenceur stérile, prélever quelques levures en
déposant l’extrémité arrondie sur le sommet d’une colonie. Strier ensuite le quartier
correspondant sur les deux boîtes de milieu.
NB : Iln’est pas nécessaire de prélever beaucoup de levures, une pointe suffit
amplement pour ensemencer.
NB : Chaque binôme va utiliser trois ensemenceurs : un par souche.
Après avoir pris soin de noter les initiales des binômes au dos des boîtes, incuber une
boîte à 25°C ou à température ambiante (20-22°C) et une boîte à 38°C.
Après 48 heures de culture, conserver les boîtes au réfrigérateur (couvercle vers le bas)
jusqu’à la séance suivante.
2.3.3 Observation des souches :
Réaliser un montage lame-lamelle des trois souches. Observer la forme des cellules.
2.4 Annexes sur les souches de levures

OS 5ème Planta/11-12
5
3.1 Principe
Permettre l’isolement de germes présents dans la gorge, leur mise en culture sur le milieu,
la sélection d’un type bactérien (E.coli par exemple) et l’observation de l’effet
d’antibiotiques sur son développement.
Les antibiotiques « déposés » (sous forme de disques imprégnés) sur la gélose
ensemencée diffusent selon un gradient de concentration.Une zone d’inhibition se crée
alors autour du disque, plus ou moins grande selon la sensibilité de la souche à cet
antibiotique.Il est donc possible de définir l’antibiotique le plus efficace contre une souche
bactérienne donnée.
3.2 Manipulation
Les différentes manipulations doivent être effectuées dans les meilleures conditions de
stérilité afin d’éviter une contamination extérieure. Bec Bunsen.
3.2.1 Préparation des boîtes
Milieu déjà prêt, placer le flacon dans un bain-marie ou sous un robinet d’eau chaude
jusqu’à liquéfaction de la gélose. Répartir dans les boîtes de Pétri stériles. Laisser
refroidir.
3.2.2 Prélèvement des germes
Le prélèvement s’effectue au moyen d’un écouvillon stérile au niveau du fond de la gorge
par exemple. Le prélèvement est ensuite mis en suspension dans une petite quantité
d’eau distillée stérile et le tout est ensemencé sur la gélose (utilisation d’une pipette
Pasteur au bout fermé et arrondi sur la flamme).
3 ANTIBIOGRAMME
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%