Synthèse et hydrolyse des esters

I- Alcools, phénols, acide carboxyliques et anhydrides d’acide
1- Alcools et phénols
Un alcool est un composé organique dans lequel le groupe hydroxyle – OH est fixé sur un atome de
carbone tétragonal.
La formule générale d’un alcool à chaîne carbonée saturée non cyclique est CnH2n+1 – OH, souvent
notée R – OH.
Suivant le nombre de chaînes carbonées portées par l’atome de carbone fonctionnel, un alcool peut être
primaire, secondaire ou tertiaire.
Le nom d’un alcool dérive de celui de l’alcane de même squelette carboné en remplaçant le -e final par
la terminaison -ol, précédée de l’indice de position du groupe hydroxyle sur la chaîne carbonée
principale.
Un phénol est un composé organique dans lequel le groupe hydroxyle – OH est porté par un cycle
benzénique.
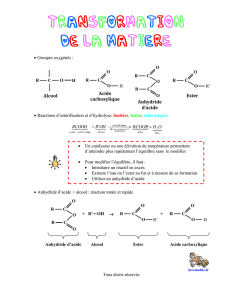
2- Acides carboxyliques
O
Un acide carboxylique possède le groupe caractéristique – C appelé groupe carboxyle.
O – H
La formule générale d’un acide à chaîne carbonée saturée non cyclique est CnH2n+1 – CO2H, souvent
notée R – CO2H.
Le nom d’un acide carboxylique dérive de celui de l’alcane de même squelette carboné en remplaçant
le -e final par la terminaison -oïque, l’ensemble étant précédé du mot acide.
La chaîne carbonée principale est numérotée à partir du groupe carboxyle.
3- Anhydrides d’acide
O O
Un anhydride d’acide est un composé organique qui possède le groupe caractéristique – C – O – C –.
Il résulte de l’élimination d’une molécule d’eau entre deux molécules d’acide carboxylique, selon
l’équation : R – C – OH + HO – C – R = R – C – O – C – R + H2O
O O O O
Un anhydride se nomme en remplaçant le mot acide par le mot anhydride dans l’acide carboxylique
correspondant.
Certains acides résultent de la déshydratation entre deux molécules d’acides carboxyliques différents.
Ces acides sont dits mixtes.
II- Esters
O
Un ester est un composé organique qui possède le groupe caractéristique – C
O – C
O
La formule générale des esters s’écrit : R – C
O – R’
Synthèse et hydrolyse
des esters

Le nom d’un ester comporte deux termes :
- le premier, qui se termine en -oate, désigne la chaîne dite principale, provenant d’un acide
carboxylique. Cette chaîne est, si nécessaire, numérotée à partir de l’atome de carbone fonctionnel.
- le second, qui se termine en -yle, est le nom du groupe alkyle provenant d’un alcool. Cette chaîne est,
si nécessaire, numérotée à partir de l’atome de carbone lié à l’atome d’oxygène.
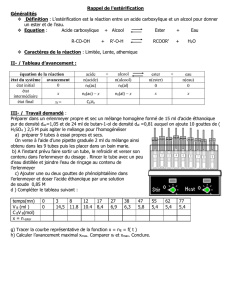
III- Synthèse des esters : estérification
1- Synthèse d’ester
Un ester peut être obtenu par la réaction d’un acide carboxylique R – CO2H avec un alcool R’ – OH
selon l’équation :
R – CO2H + R’ – OH = R – CO2 R’ + H2O
acide + alcool = ester + eau
L’ion H+ est un catalyseur de cette synthèse.
2- Rendement d’une synthèse d’ester
Le rendement de la synthèse ρ est donné par le quotient de la quantité d’ester obtenu nf(ester) par la
quantité maximale d’ester attendue nmax(ester) :
ρ = =
IV- Hydrolyse des esters
L’eau hydrolyse tout ester R – CO2 R’ pour donner l’acide carboxylique R – CO2H et l’alcool R’ – OH
correspondants selon l’équation :
R – C – O – R’ + H2O = R – C – O – H + R’ – OH
O O
ester + eau = acide + alcool
Les ions H+ catalysent de cette réaction.
nf(ester)
nmax(ester)
nf(ester)
n(réactif limitant)
1
/
2
100%