Navette citrique

1
METABOLISME
DE L’EXERCICE
UV 303/308
OXYDOREDUCTION
P. PILARDEAU

2
METABOLISME DE L’OXYDO REDUCTION
Les mécanismes d’oxydoréduction appartiennent à quatre grandes catégories :
= La lutte contre les agents pathogènes,
= La détoxification des xénobiotiques,
= Un certain nombre de synthèses,
= Le système respiratoire cellulaire, connu sous le nom de chaîne d’oxydoréduction
ou chaîne respiratoire.
Au sein de ces systèmes le transfert des électrons est assuré par les flavoprotéines et des
hémoprotéines contenant du fer (sous forme Fe ++ ou Fe+++ seul ou associé à du cuivre ou du soufre)
appelés cytochromes.
Ces transferts sont à l’origine de la formation de radicaux libres particulièrement toxiques
(anion superoxyde 02-) qui nécessiteront d’être éliminés pour préserver les structures protéiques et
lipidiques des tissus.
I DANS LA MITOCHONDRIE
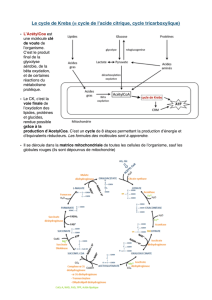
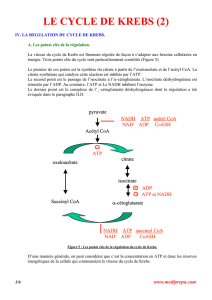
1.1 CYCLE DE KREBS
Le cycle de Krebs ou cycle tricarboxylique existe dans toutes les cellules de l’organisme
humain à l’exception des érythrocytes.
Les enzymes qui le constituent se trouvent placées au niveau de la membrane interne de
la mitochondrie ce qui facilite le transfert des équivalents réducteurs aux enzymes de la chaîne
respiratoire.
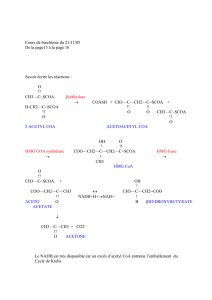
Le cycle de Krebs a pour fonction d’oxyder un acétyl CoA. (CH3-CO-SCoA) en 2 CO2 et
H2O. Il comprend 10 réactions dont deux seulement sont irréversibles, la citrate synthétase et l’alpha
cétoglutarate déshydrogénase.
Condensation de l’acétyl CoA avec oxaloacétate
ATP NADH2
- - - - - -
Citrate synthétase
Oxaloacétate + Acétyl-CoA Acide citrique
CH2 -COOH CH2-COOH
I + CH3-CO-SCoA + HS-CoA I
CO-COOH OH-C-COOH
I
CH2-COOH
Cette réaction est inhibée par l’ATP et le NADH2 et un excès de citrate.

3
Pendant l’exercice d’intensité modérée l’apport suffisant d’oxaloacétate et la bonne
réoxydation des NADH2 par la chaîne respiratoire permet un fonctionnement satisfaisant de cette
réaction. La baisse locale de l’ATP, l’utilisation du citrate dans le cycle et la faible concentration en
NADH2, permettent de lever l’inhibition portant sur la citrate synthétase.
Si l’intensité de l’exercice croît l’effondrement de l’ATP et le maintien à une concentration
modérée des NADH2 permet une accélération considérable de l’activité de la citrate synthétase.
Cependant, si l’exercice dépasse un certain seuil d’intensité (VO2 max locale), le
« débordement » de la chaîne respiratoire est alors responsable d’une augmentation de la
concentration des NADH2 mitochondriaux qui tendent à infléchir la vitesse de la citrate synthétase.
Activité de la
citrate synthétase
Repos Exercice Exercice maximal
Isomérisation de l’acide citrique
Grâce à une aconitase l’acide citrique peut dans un premier temps se déshydrater en acide cis-
aconitique puis se réhydrater en acide iso citrique. Cette réaction est réversible.
CH2-COOH CH-COOH HOCH-COOH
I H2O II H2O I
OH-C-COOH C-COOH CH-COOH
I I I
CH2-COOH CH2-COOH CH2-COOH
Acide citrique Acide cis citrique Acide isocitrique
Oxydation de l’acide iso citrique
La réaction est catalysée par l’isocitrico-déshydrogénase . Elle se réalise en deux temps, la
déshydrogénation puis la décarboxylation.
NADH2 Isocitrico-déshydrogénase
- - -
Acide isocitrique acide oxalo acide alpha
succinique céto-glutarique
NAD NADH2 CO2

4
HOHC-COOH + NAD O = C-COOH NADH2
I I
CH-COOH CH2 + CO2
I I
CH2-COOH CH2-COOH
Acide isocitrique Acide alpha céto glutarique
La vitesse de cette réaction enzymatique est freinée par un excès de NADH2.
Pour les exercices de faible intensité la vitesse de cette enzyme dépend essentiellement de
l’apport en substrat.
Si l’exercice est de forte intensité, mais ne dépasse pas les capacités oxydatives de la chaîne
respiratoire, la vitesse est maximale (synthèse très importante de citrate à partir de l’oxaloacétate issu
de la désamination de l’acide aspartique ou du pyruvate, et des acétyl CoA en provenance de la bêta
oxydation. Dans le cas contraire l’excès de NADH2 freine la vitesse de la réaction (exercice minimal).
Cette réaction existe également dans le cytoplasme, mais dans ce cas l’accepteur de proton est le
NADP.
Décarboxylation oxydative de l’alphacéto-glutarate
Cette réaction a pour coenzyme le pyrophosphate de thiamine (vitamine B1) et de l’acide lipoïque.
Le transfert des protons sur le NAD est assuré par ce dernier qui fixe les H+ en ouvrant son pont
disulfure. Il s’agit d’une réaction irréversible.
Alpha cétoglutarate déshydrogénase
Acide alpha céto glutarique Succinyl CoA + CO2
HS-CoA
NAD NADH2
CO-COOH + HS-CoA CO-S-CoA + CO2
I I
CH2 CH2
I I
CH2 CH2 + NADH2
I I
COOH COOH
Acide alpha céto glutarique Succinyl CoA
Formation de l’acide succinique

5
Cette réaction consiste à récupérer l’énergie contenue dans la liaison acétyl CoA sur un GDP. Elle
est réversible et catalysée par la succinate thiokinase.
C’est la seule réaction du cycle de Krebs libérant directement de l’énergie. Le GTP formé
peut être utilisé localement comme second messager (GMPc) ou redonner du GDP par le transfert
d’une liaison riche sur de l’ADP.
CO-S-CoA COOH
I Succinate thiokinase I
CH2 CH2 + HS-CoA
I GDP GTP I
CH2 CH2
I I
COOH COOH
Succinyl CoA Acide succinique
Oxydation de l’acide succinique
L’acide succinique est déshydrogéné de façon réversible par la succinate déshydrogénase, enzyme
utilisant le FAD.
COOH COOH
I Succinate déshydrogénase I
CH2 CH
I II
CH2 FAD FADH2 CH
I I
COOH COOH
Acide succinique Acide fumarique
La vitesse de cette réaction dépend de la concentration des substrats et notamment du FAD
sous sa forme oxydée. Comme toutes les réactions d’oxydoréduction du cycle de Krebs sa vitesse
augmente en fonction de l’intensité de l’exercice jusqu’au moment où la chaîne respiratoire se trouve
débordée par la quantité de substances réduites (NADH2 et FADH2) à oxyder.
Formation de l’acide malique
Il s’agit d’une simple réaction d’hydratation catalysée par la fumarase.
H-C-COOH Fumarase OH-CH-COOH
II I
HOOC-C-H + H2O CH2-COOH
Acide fumarique Acide malique
Oxydation de l’acide malique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%